Иерсиний псевдотуберкулез - Yersinia pseudotuberculosis
| Иерсиний псевдотуберкулез | |
|---|---|
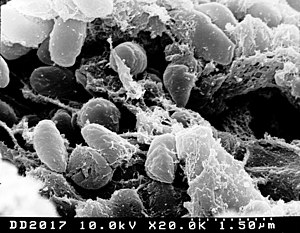 | |
| Иерсиния сканирована с помощью электронной микрофотографии | |
| Специальность | Инфекционное заболевание |
| Иерсиний псевдотуберкулез | |
|---|---|
| Научная классификация | |
| Домен: | |
| Тип: | |
| Учебный класс: | |
| Заказ: | |
| Семья: | |
| Род: | |
| Разновидность: | Ю. псевдотуберкулез |
| Биномиальное имя | |
| Иерсиний псевдотуберкулез (Пфайфер 1889) Смит и Тал 1965 | |
Иерсиний псевдотуберкулез это Грамотрицательный бактерия что вызывает Дальневосточная скарлатина у людей, которые иногда заражаются зоонотически, чаще всего через пищевые продукты.[1] Животные также заражены Ю. псевдотуберкулез. Бактерия уреаза положительный.
Патогенез
У животных Ю. псевдотуберкулез может вызвать туберкулез -подобные симптомы, включая локализованные ткани некроз и гранулемы в селезенка, печень, и лимфатический узел.
У людей симптомы Дальневосточная скарлатина похожи на заражения Yersinia enterocolitica (лихорадка и боль в животе справа), за исключением того, что диарейный компонент часто отсутствует, что иногда затрудняет диагностику возникшего в результате этого состояния. Ю. псевдотуберкулез инфекции могут имитировать аппендицит, особенно у детей и молодых людей, и в редких случаях заболевание может вызывать кожные жалобы (узловатая эритема ), скованность суставов и боль (реактивный артрит ) или распространение бактерий в кровь (бактериемия ).
Дальневосточная скарлатина обычно проявляется через 5-10 дней после заражения и обычно длится от одной до трех недель без лечения. В сложных случаях или связанных с с ослабленным иммунитетом пациентам для выздоровления могут потребоваться антибиотики; ампициллин, аминогликозиды, тетрациклин, хлорамфеникол, или цефалоспорин все может быть эффективным.
Недавно описанный синдром «Идзуми-лихорадка» был связан с инфицированием Ю. псевдотуберкулез.[2]
Симптомы лихорадки и боли в животе, имитирующие аппендицит (фактически от мезентериального лимфаденита) [3][4][5] связана с Ю. псевдотуберкулез Инфекции не типичны для диареи и рвоты в результате классических случаев пищевого отравления. Несмотря на то что Ю. псевдотуберкулез обычно способны колонизировать хозяев периферическими путями и вызывать серьезные заболевания у лиц с ослабленным иммунитетом, если эта бактерия получает доступ к кровотоку, у нее есть LD50 сравним с Y. pestis всего 10 КОЕ.[6]
Отношение к Y. pestis
Генетически возбудитель, вызывающий чума, Y. pestis, очень похоже на Ю. псевдотуберкулез. Чума, похоже, произошла от Ю. псевдотуберкулез примерно от 1500 до 20 000 лет назад.[7] Статья 2015 г. Клетка выступал за более раннее расхождение.[8]
Факторы вирулентности
Чтобы облегчить прикрепление, вторжение и колонизацию своего хозяина, эта бактерия обладает множеством факторы вирулентности. Суперантигены, бактериальные адгезии и действие Yops (которые когда-то считались бактериальными белками "Иерсиния белки внешней мембраны »), которые кодируются в« [плазмиде] для Иерсиния вирулентность », широко известная как pYV, вызывает патогенез хозяина и позволяет бактериям паразитировать.
pYV
70-kb pYV имеет решающее значение для Иерсинияпатогенность, так как содержит много гены известно, что он кодирует факторы вирулентности, и его потеря дает авирулентность всех Иерсиния разновидность.[6] «Центральная область» размером 26 т.п.н. в pYV содержит ysc гены, которые регулируют экспрессию и секрецию Yops.[5] Многие белки Ysc также объединяются с образованием секреторного аппарата типа III, который секретирует много Yops в клетку-хозяин. цитоплазма с помощью «аппарата транслокации», сконструированного из YopB и YopD.[9][10] В основной регион также входят yopN, yopB, yopD, tyeA, lcrG, и lcrV, которые также регулируют Yops экспрессия гена и помогают перемещать секреторные Yops к клетке-мишени.[5] Например, YopN и TyeA позиционируются как заглушка на устройстве, поэтому только их конформационное изменение, вызванное их взаимодействием с определенными белками мембран клетки-хозяина, вызовет разблокировку секреторного пути.[5][11] Секреция регулируется таким образом, чтобы белки не попадали в внеклеточный матрикс и вызвать иммунная реакция. Поскольку этот путь обеспечивает селективность секреции, он является фактором вирулентности.
Эффектор Йопс
В отличие от ysc и йоп перечисленные выше гены Yops, которые действуют непосредственно на клетки-хозяева, вызывая цитопатологические эффекты - «эффекторные Yops» - кодируются pYV гены, внешние по отношению к этой основной области.[5] Единственным исключением является LcrV, который также известен как «универсальный Yop» за его две роли: эффекторный Yop и регуляторный Yop.[5] Комбинированная функция этих эффекторных Yops позволяет бактериям противостоять интернализации иммунными и кишечными клетками и уклоняться от бактерицидного действия нейтрофилы и макрофаги. Внутри бактерии эти Yops связаны pYV-кодированные Sycs (специфические шапероны Yop), которые предотвращают преждевременное взаимодействие с другими белками и направляют Yops к секреторному аппарату типа III.[10] В дополнение к комплексу Syc-Yop, Yops также помечены для секреции типа III либо первыми 60nt в их соответствующих мРНК транскрипт или их соответствующие первые 20 N-концевых аминокислоты.[4]LcrV, YopQ, YopE, YopT, YopH, YpkA, YopJ, YopM и YadA все секретируются секреторным путем типа III.[4][5][11] LcrV подавляет нейтрофилы хемотаксис и цитокин производство, позволяющее Ю. псевдотуберкулез образовывать большие колонии, не вызывая системного сбоя[11] и вместе с YopQ способствует процессу транслокации, перенося YopB и YopD в эукариотические клетки. клеточная мембрана для порообразования.[4][12] Вызывая деполимеризацию актиновых филаментов, YopE, YopT и YpkA сопротивляются эндоцитоз клетками кишечника и фагоцитоз давая цитотоксические изменения в клетке-хозяине. YopT нацелен на Rho GTPase, обычно называемую «RhoA», и отделяет ее от мембраны, оставляя ее в неактивном состоянии, связанном с RhoA-GDI (ингибитор диссоциации гуаниновых нуклеотидов).[13] тогда как YopE и YpkA конвертируют белки Rho в их неактивные состояния, связанные с GDP, посредством экспрессии активности GTPase.[11] YpkA также катализирует серин аутофоспорилирование, поэтому оно может выполнять регуляторные функции в Иерсиния[14] или подрывают каскады сигналов иммунного ответа клетки-хозяина, поскольку YpkA нацелен на цитоплазматическую сторону мембраны клетки-хозяина.[15] YopH действует на сайты фокальной адгезии хозяина, дефосфорилируя несколько фосфотирозин остатки на киназа фокальной адгезии (FAK) и белки фокальной адгезии паксиллин и p130.[16] Поскольку фосфорилирование FAK участвует в поглощении иерсиний[17] а также Т-клетка и В клетка ответы на связывание антигена,[11] YopH вызывает антифагоцитарный и другие антииммунные эффекты. YopJ, который разделяет оперон с YpkA, «... препятствует активности митоген-активированного протеина (MAP) киназы N-концевой киназы c-Jun (JNK), p38 и киназы, регулируемой внеклеточными сигналами»,[18] приводит к макрофагам апоптоз.[4] Кроме того, YopJ ингибирует высвобождение TNF-α из многих типов клеток, возможно, посредством ингибирующего действия на NF-κB, подавляя воспаление и иммунный ответ.[19] Посредством секреции по пути типа III и локализации в ядре с помощью ассоциированного с везикулами, зависимого от микротрубочек метода, YopM может изменять рост клетки-хозяина путем связывания с RSK (рибосомная киназа S6), которая регулирует гены регуляции клеточного цикла.[11] YadA потеряла адгезию,[20] опсонизация -резистентные, устойчивые к фагоцитозу и респираторный взрыв -сопротивляющиеся функции[21][22] в Ю. псевдотуберкулез из-за мутация сдвига рамки путем делеции одной пары оснований в yadA в сравнении с yadA в Y. enterocolitica, тем не менее, он все еще секретируется секрецией типа III.[23] В йоп гены yadA, ylpA, а virC оперон считается «регулятором Yop», поскольку он корегулируется вирусом VirF, кодируемым pYV. virF в свою очередь терморегулируется. При 37 градусах Цельсия хромосомно закодированный Ymo, регулирующий Суперспирализация ДНК вокруг virF Ген изменяет конформацию, обеспечивая экспрессию VirF, которая затем регулирует Yop-регулон.[24]
Адгезия
Ю. псевдотуберкулез прочно прилипает к клеткам кишечника посредством кодируемых хромосом белков[4] так что может возникнуть секреция Yop, чтобы избежать ее удаления перистальтика, и для вторжения в клетки-мишени. Трансмембранный белок, вторжение, облегчает эти функции, связываясь с клеткой-хозяином αβ1 интегрины.[25] Посредством этого связывания интегрины образуют кластер, тем самым активируя FAK и вызывая соответствующую реорганизацию цитоскелета.[4][25] Последующая интернализация связанных бактерий происходит, когда актин-деполимеризирующие Yops не экспрессируются.[11] Белок, кодируемый в «локусе инвазии прикрепления» под названием Ail, также наделяет иерсиний способностями прикрепления и инвазии.[26] препятствуя связыванию комплемента на бактериальной поверхности.[27] Для увеличения специфичности связывания фибриллярный антиген pH6 нацеливает бактерии на клетки кишечника только при термоиндукции.[28]
Суперантигены
Определенные штаммы Иерсиний псевдотуберкулез экспрессируют суперантигенный экзотоксин, YPM или Ю. псевдотуберкулез-производный митоген из хромосомных ypm ген.[29] YPM специфически связывает и вызывает пролиферацию Т-лимфоцитов, экспрессирующих вариабельные области Vβ3, Vβ7, Vβ8, Vβ9, Vβ13.1 и Vβ13.2. [30] с CD4 + Т-клетки предпочтение, хотя активация некоторых CD8 + Т-клетки происходит.[3] Это расширение Т-лимфоцитов может вызвать спленомегалия в сочетании с Ил-2 и Ил-4 перепроизводство.[31] С момента введения анти-TNF-α и анти-IFN-γ моноклональный антитела нейтрализует токсичность YPM in vivo,[29] эти цитокины в значительной степени ответственны за ущерб, косвенно вызванный экзотоксин. Штаммы, несущие ген экзотоксина, редко встречаются в западных странах, где болезнь, когда она вообще очевидна, проявляется в основном незначительными симптомами, тогда как более 95% штаммов из стран Дальнего Востока содержат ypm[32] и коррелируют с лихорадкой Идзуми и Болезнь Кавасаки.[33]Хотя суперантиген представляет наибольшую угрозу для здоровья хозяина, все факторы вирулентности способствуют Ю. псевдотуберкулез жизнеспособность in vivo и определить патогенные характеристики бактерии. Ю. псевдотуберкулез могут жить внеклеточно благодаря своим грозным механизмам фагоцитоза и опсонизация устойчивость через экспрессию Yops и путь типа III;[10] тем не менее, благодаря ограниченному действию pYV, он может заселять клетки-хозяева, особенно макрофаги, внутриклеточно, чтобы в дальнейшем уклоняться от иммунных ответов и распространяться по организму.[34]
| YpM | |||||||||
|---|---|---|---|---|---|---|---|---|---|
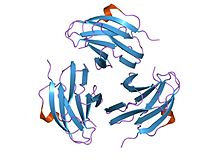 кристаллическая структура митогена, полученного из yersinia pseudotuberculosis (ypm) | |||||||||
| Идентификаторы | |||||||||
| Символ | YpM | ||||||||
| Pfam | PF09144 | ||||||||
| ИнтерПро | IPR015227 | ||||||||
| SCOP2 | 13:00 4 / Объем / СУПФАМ | ||||||||
| |||||||||
Функция
Иерсиний псевдотуберкулез-производные митогены (YpM) являются суперантигены, которые способны чрезмерно активировать Т-клетки к привязка к Т-клетке рецептор. Поскольку YpM может активировать большое количество популяции Т-клеток, это приводит к высвобождению воспалительного цитокины.
Структура
Члены этой семьи Иерсиний псевдотуберкулез митогены принять бутерброд структура состоящий из 9 нитей в двух бета-листах, в рулет из желе топология. Молекулярная масса YpM составляет около 14 кДа. Структурно он не похож ни на один другой суперантиген, но очень похож на фактор некроза опухоли и белки вирусного капсида. Это наводит на мысль о возможных эволюционных отношениях.[35]
Подсемейства
Были охарактеризованы некоторые высокогомологичные варианты YPM, включая YPMa, YPMb и YPMc.
малая некодирующая РНК
Многочисленные бактериальные малые некодирующие РНК было установлено, что они играют регулирующие функции. Некоторые могут регулировать гены вирулентности. 150 неаннотированных мРНК были идентифицированы путем секвенирования Ю. псевдотуберкулез Библиотеки РНК из бактерий, выращенных при 26 ° C и 37 ° C, предполагают, что они могут играть роль в патогенезе.[36] Используя одну молекулу флуоресценция in situ гибридизация Методом smFISH было показано, что количество РНК YSR35 увеличивалось в 2,5 раза при изменении температуры от 25 ° C до 37 ° C.[37] Другое исследование показало, что глобальное перепрограммирование центральных метаболических функций, вызванное температурой, вероятно, будет поддерживать кишечную колонизацию патогена. Регулирующие РНК, контролируемые окружающей средой, координируют контроль метаболизма и вирулентности, обеспечивая быструю адаптацию и высокую гибкость при изменении образа жизни.[38] Высокопроизводительное зондирование структуры РНК позволило идентифицировать многие термореактивные структуры РНК.[39]
Смотрите также
Рекомендации
- ^ Райан К.Дж.; Рэй CG, ред. (2004). Шеррис Медицинская микробиология (4-е изд.). Макгроу Хилл. ISBN 978-0-8385-8529-0.
- ^ Яни, Асим (2003). «Псевдотуберкулез (Ерсина)». Получено 2006-03-04.
- ^ а б Carnoy, C .; Lemaitre, N .; Симоне, М. (2005). «Суперантигенный токсин Yersinia pseudotuberculosis». В Ладанте, Даниэль; Alouf, Joseph E .; Попофф, Мишель Р. (ред.). Всеобъемлющий справочник токсинов бактериального белка. Академическая пресса. С. 862–871. ISBN 978-0-08-045698-0.
- ^ а б c d е ж грамм Робинс-Браун, Р.; Хартленд, Э. (2003). «Вид иерсиний». В Miliotis, Marianne D .; Бир, Джеффри В. (ред.). Международный справочник патогенов пищевого происхождения. CRC Press. С. 323–355. ISBN 978-0-203-91206-5.
- ^ а б c d е ж грамм Линдлер, Л. (2004). "Плазмиды вирулентности Иерсиния: характеристики и сравнение ». In Funnell, B.E .; Phillips, G.J. (eds.). Биология плазмид. ASM Press. С. 423–437. ISBN 978-1555812652.
- ^ а б Брубейкер Р.Р. (1983). «Фактор вирулентности Vwa + иерсиний: молекулярная основа сопутствующей пищевой потребности Са ++». Rev. Infect. Дис. 5 (Приложение 4): S748–58. Дои:10.1093 / Clinids / 5.supplement_4.s748. PMID 6195719.
- ^ Ахтман, М .; Zurth, K .; Морелли, G .; Torrea, G .; Guiyoule, A .; Карниэль, Э. (23 ноября 1999 г.). "Yersinia pestis, вызывающая чуму, представляет собой недавно появившийся клон Yersinia pseudotuberculosis ». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 96 (24): 14043–8. Дои:10.1073 / пнас.96.24.14043. ЧВК 24187. PMID 10570195.
- ^ Расмуссен, Саймон; Аллентофт, Мортен Эрик; Нильсен, Каспер; Орландо, Людовик; Сикора, Мартин; Сьегрен, Карл-Йоран; Педерсен, Андерс Горм; Шуберт, Миккель; Ван Дам, Алекс; Капель, Кристиан Мольин Аутцен; Нильсен, Хенрик Бьёрн; Брунак, Сорен; Аветисян, Павел; Епимахов Андрей; Халяпин Михаил Викторович; Гнуни, Артак; Крийска, Айвар; Ласак, Ирена; Мецпалу, Майт; Моисеев, Вячеслав; Громов, Андрей; Покутта, Далия; Сааг, Лехти; Варул, Лийви; Епископосян, Левон; Зихериц-Понтен, Томас; Фоли, Роберт А.; Лар, Марта Миразон; Нильсен, Расмус; и другие. (2015). "Ранние расходящиеся штаммы Yersinia pestis в Евразии 5000 лет назад". Клетка. 163 (3): 571–582. Дои:10.1016 / j.cell.2015.10.009. ЧВК 4644222. PMID 26496604.CS1 maint: несколько имен: список авторов (связь)
- ^ Ириарте М, Корнелис Г.Р. (1999). "Идентификация SycN, YscX и YscY, трех новых элементов Иерсиния йоп вирулон ". J. Bacteriol. 181 (2): 675–80. ЧВК 93427. PMID 9882687.
- ^ а б c Корнелис Г.Р., Боланд А., Бойд А.П., Гейджен С., Ириарте М., Нейт С., Сори М.П., Стейнир I (1998). "Плазмида вирулентности Иерсиния, антихозяинный геном ". Microbiol. Мол. Биол. Rev. 62 (4): 1315–52. Дои:10.1128 / MMBR.62.4.1315-1352.1998. ЧВК 98948. PMID 9841674.
- ^ а б c d е ж грамм Ли В. Т., Там С, Шнеуинд О (2000). «LcrV, субстрат для Yersinia enterocolitica секреция типа III требуется для нацеливания токсина в цитозоль клеток HeLa ». J. Biol. Chem. 275 (47): 36869–75. Дои:10.1074 / jbc.M002467200. PMID 10930402.
- ^ Zumbihl R, Aepfelbacher M, Andor A, Jacobi CA, Ruckdeschel K, Rouot B, Heesemann J (1999). "Цитотоксин YopT из Yersinia enterocolitica индуцирует модификацию и клеточное перераспределение небольшого GTP-связывающего белка RhoA ». J. Biol. Chem. 274 (41): 29289–93. Дои:10.1074 / jbc.274.41.29289. PMID 10506187.
- ^ Persson C, Carballeira N, Wolf-Watz H, Fällman M (1997). "PTPase YopH ингибирует поглощение Иерсиния, фосфорилирование тирозина p130Cas и FAK, и связанное с этим накопление этих белков в периферических фокальных адгезиях ». EMBO J. 16 (9): 2307–18. Дои:10.1093 / emboj / 16.9.2307. ЧВК 1169832. PMID 9171345.
- ^ Håkansson S, Galyov EE, Rosqvist R, Wolf-Watz H (1996). "The Иерсиния Киназа YpkA Ser / Thr перемещается и затем направляется на внутреннюю поверхность плазматической мембраны клетки HeLa ». Мол. Микробиол. 20 (3): 593–603. Дои:10.1046 / j.1365-2958.1996.5251051.x. PMID 8736538.
- ^ Ruckdeschel K, Machold J, Roggenkamp A, Schubert S, Pierre J, Zumbihl R, Liautard JP, Heesemann J, Rouot B (1997). "Yersinia enterocolitica способствует дезактивации митоген-активируемых протеинкиназ макрофагов, регулируемых внеклеточными сигналами киназы-1/2, p38 и c-Jun NH2-концевой киназы. Корреляция с его ингибирующим действием на продукцию фактора некроза опухоли альфа ». J. Biol. Chem. 272 (25): 15920–7. Дои:10.1074 / jbc.272.25.15920. PMID 9188492.
- ^ Альрутц М.А., Исберг Р.Р. (1998). «Участие киназы фокальной адгезии в инвазин-опосредованном захвате». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 95 (23): 13658–63. Дои:10.1073 / пнас.95.23.13658. ЧВК 24875. PMID 9811856.
- ^ Галев Е.Е., Хоканссон С., Форсберг А., Вольф-Ватц Х. (1993). "Секретируемая протеинкиназа Иерсиний псевдотуберкулез является незаменимым детерминантом вирулентности ". Природа. 361 (6414): 730–2. Дои:10.1038 / 361730a0. PMID 8441468.
- ^ Боланд А., Корнелис Г. Р. (1998). «Роль YopP в подавлении высвобождения альфа фактора некроза опухоли макрофагами во время Иерсиния инфекционное заболевание". Заразить. Иммунная. 66 (5): 1878–84. ЧВК 108138. PMID 9573064.
- ^ Скурник М., эль-Тахир Ю., Сааринен М., Ялканен С., Тойванен П. (1994). «YadA опосредует специфическое связывание энтеропатогенных Yersinia enterocolitica к подслизистой оболочке кишечника человека ". Заразить. Иммунная. 62 (4): 1252–61. ЧВК 186266. PMID 8132332.
- ^ Чайна Б., Сори депутат, Н'Гуен Б.Т., Де Брюйер М., Корнелис Г.Р. (1993). «Роль белка YadA в предотвращении опсонизации Yersinia enterocolitica молекулами C3b ". Заразить. Иммунная. 61 (8): 3129–36. ЧВК 280979. PMID 8335343.
- ^ Чайна Б., Н'Гуен Б.Т., де Брюйер М., Корнелис Г.Р. (1994). "Роль Яда в сопротивлении Yersinia enterocolitica к фагоцитозу полиморфно-ядерными лейкоцитами человека ». Заразить. Иммунная. 62 (4): 1275–81. ЧВК 186269. PMID 8132334.
- ^ Хан YW, Миллер VL (1997). «Переоценка фенотипа вирулентности двойных мутантов inv yadA Иерсиний псевдотуберкулез". Заразить. Иммунная. 65 (1): 327–30. ЧВК 174597. PMID 8975933.
- ^ Корнелис Г.Р., Слютерс С., Делор И., Гейб Д., Канига К., Ламберт де Рувруа С., Сори М.П., Ванутегем Дж.С., Михильс Т. (1991). "ymoA, a Yersinia enterocolitica хромосомный ген, модулирующий выражение функций вирулентности ». Мол. Микробиол. 5 (5): 1023–34. Дои:10.1111 / j.1365-2958.1991.tb01875.x. PMID 1956283.
- ^ Исберг Р.Р., Ван Ньеу GT (1994). «Две стратегии интернализации клеток млекопитающих, используемые патогенными бактериями». Анну. Преподобный Жене. 28: 395–422. Дои:10.1146 / annurev.ge.28.120194.002143. PMID 7893133.
- ^ а б Миллер, В. (1992). "Иерсиния гены вторжения и их продукты ". Новости ASM. 58: 26–33.
- ^ Блиска Дж. Б., Фальков С. (1992). «Бактериальная устойчивость к уничтожению комплемента, опосредованная белком Ail Yersinia enterocolitica". Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 89 (8): 3561–5. Дои:10.1073 / пнас.89.8.3561. ЧВК 48908. PMID 1565652.
- ^ Линдлер Л. Е., Высокий Б. Д. (1993). "Yersinia pestis Антиген pH 6 образует фимбрии и индуцируется внутриклеточной ассоциацией с макрофагами ». Мол. Микробиол. 8 (2): 311–24. Дои:10.1111 / j.1365-2958.1993.tb01575.x. PMID 8100346.
- ^ Миёси-Акияма Т., Фудзимаки В., Ян XJ, Яги Дж., Иманиши К., Като Х., Томонари К., Учияма Т. (1997). «Идентификация мышиных Т-клеток, реактивных с бактериальным суперантигеном. Иерсиний псевдотуберкулез-производный митоген (YPM) и факторы, участвующие в YPM-индуцированной токсичности у мышей ». Microbiol. Иммунол. 41 (4): 345–52. Дои:10.1111 / j.1348-0421.1997.tb01211.x. PMID 9159409.
- ^ а б Учияма Т., Миёси-Акияма Т., Като Х., Фуджимаки В., Иманиши К., Ян XJ (1993). «Суперантигенные свойства нового митогенного вещества, производимого Иерсиний псевдотуберкулез изолированы от пациентов с острыми и системными симптомами ». J. Immunol. 151 (8): 4407–13. PMID 8409410.
- ^ Карной С., Лойз С., Фавью С., Гранжет С., Дезремо П., Симоне М. (2003). Воздействие Иерсиний псевдотуберкулез-производный митоген (YPM) в иммунной системе мышей. Adv. Exp. Med. Биол. Успехи экспериментальной медицины и биологии. 529. С. 133–5. Дои:10.1007/0-306-48416-1_26. ISBN 978-0-306-47759-1. PMID 12756744.
- ^ Йошино К., Рамамурти Т., Наир Г.Б., Фукусима Х., Охтомо Й., Такеда Н., Канеко С., Такеда Т. (1995). "Географическая неоднородность между Дальним Востоком и Европой в распространенности гена ypm, кодирующего новый суперантиген, среди Иерсиний псевдотуберкулез штаммы ". J. Clin. Микробиол. 33 (12): 3356–8. ЧВК 228710. PMID 8586739.
- ^ Фукусима Х, Мацуда Й, Секи Р., Цубокура М., Такеда Н., Шубин Ф. Н., Пайк И. К., Чжэн Х Б. (2001). «Географическая неоднородность между странами Дальнего Востока и Запада в распространенности плазмиды вирулентности, суперантигена. Иерсиний псевдотуберкулез-производный митоген, и остров высокой патогенности среди Иерсиний псевдотуберкулез штаммы ". J. Clin. Микробиол. 39 (10): 3541–7. Дои:10.1128 / JCM.39.10.3541-3547.2001. ЧВК 88386. PMID 11574570.
- ^ Николова С., Найденский Х., Весселинова Д., Веселинова А., Казачка Д., Нейков П. (1997). «Иммунологические и электронно-микроскопические исследования свиней, инфицированных Yersinia enterocolitica 0:3". Zentralbl. Бактериол. 286 (4): 503–10. Дои:10.1016 / s0934-8840 (97) 80053-9. PMID 9440199.
- ^ Смит М.Г. (1992). «Уничтожение бактерий на свежем мясе горячей водой». Эпидемиол. Заразить. 109 (3): 491–6. Дои:10,1017 / с0950268800050482. ЧВК 2271933. PMID 1468533.
- ^ Донадини Р., Лью К.В., Кван А.Х., Маккей Дж. П., Филдс Б.А. (январь 2004 г.). «Кристаллическая структура и структура раствора суперантигена из Yersinia pseudotuberculosis обнаруживают складку желеобразной формы». Структура. 12 (1): 145–56. Дои:10.1016 / j.str.2003.12.002. PMID 14725774.
- ^ Ку, Йованка Т .; Alleyne, Trevis M .; Скиано, Челси А .; Джафари, Надере; Латем, Уиндем У. (13 сентября 2011 г.). «Глобальное открытие малых РНК у Yersinia pseudotuberculosis позволяет идентифицировать специфичные для Yersinia малые некодирующие РНК, необходимые для вирулентности». Труды Национальной академии наук Соединенных Штатов Америки. 108 (37): E709–717. Дои:10.1073 / pnas.1101655108. ISSN 1091-6490. ЧВК 3174644. PMID 21876162.
- ^ Шеперд, Дуглас П .; Ли, Нан; Мичева-Витева, София Н .; Мунски, Брайан; Хонг-Геллер, Элизабет; Вернер, Джеймс Х. (21 мая 2013 г.). «Подсчет малых РНК в патогенных бактериях». Аналитическая химия. 85 (10): 4938–4943. Дои:10.1021 / ac303792p. ISSN 1520-6882. PMID 23577771.
- ^ Нусс, Аарон М .; Героевен, Энн Катрин; Вальдманн, Барбара; Рейнкенсмайер, Ян; Ярек, Майкл; Бекстетт, Майкл; Дерш, Петра (01.03.2015). «Транскриптомное профилирование Yersinia pseudotuberculosis выявляет перепрограммирование регулона Crp под воздействием температуры и раскрывает Crp как главный регулятор малых РНК». PLoS Genetics. 11 (3): e1005087. Дои:10.1371 / journal.pgen.1005087. ISSN 1553-7404. ЧВК 4376681. PMID 25816203.
- ^ Ригетти, Франческо; Нусс, Аарон М .; Твиттенхофф, Кристиан; Биле, Саша; Урбан, Кристина; Уилл, Себастьян; Bernhart, Stephan H .; Стадлер, Питер Ф .; Дерш, Петра (28.06.2016). «Термочувствительная структура РНК in vitro Yersinia pseudotuberculosis». Труды Национальной академии наук Соединенных Штатов Америки. 113 (26): 7237–7242. Дои:10.1073 / pnas.1523004113. ISSN 1091-6490. ЧВК 4932938. PMID 27298343.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
