Генетика старения - Genetics of aging
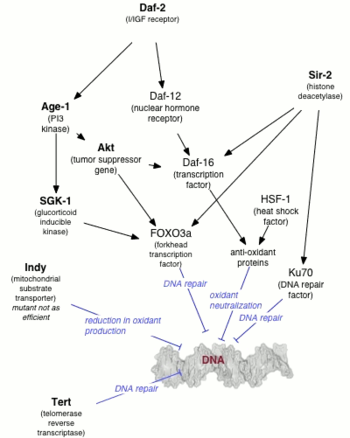
Генетика старения обычно занимается продление жизни связаны с генетическими изменениями, а не с болезни ускоренного старения что приводит к сокращению продолжительности жизни.
Первый мутация найдено, чтобы увеличить долголетие в животном был возраст-1 ген в Caenorhabditis elegans. Майкл Класс обнаружил, что продолжительность жизни C. elegans могли быть изменены мутациями, но Класс полагал, что эффект был связан с уменьшением потребления пищи (ограничение калорий ).[1] Томас Джонсон позже показал, что продление жизни до 65% было связано с самой мутацией, а не с ограничением калорийности,[2] и он назвал ген возраст-1 в ожидании обнаружения других генов, контролирующих старение. В возраст-1 ген кодирует каталитическую субъединицу фосфатидилинозитол-3-киназа класса I (PI3K).
Спустя десятилетие после открытия Джонсона daf-2, один из двух генов, необходимых для личинка дауэра формирование[3] был показан Синтия Кеньон удвоить C. elegans срок жизни.[4] Кеньон показал, что daf-2 мутанты, которые будут формировать дауэры при температуре выше 25 ° C (298 K; 77 ° F), будут обходить состояние дауэра при температуре ниже 20 ° C (293 K; 68 ° F) с удвоением продолжительности жизни.[4] До исследования Кеньона обычно считалось, что продолжительность жизни можно увеличить только за счет потери репродуктивной способности, но нематоды Кеньона сохраняли репродуктивную способность в молодом возрасте, а также увеличивали молодость в целом. Последующая генетическая модификация (мутация PI3K-null) для C. elegans было показано, чтобы расширить максимальная продолжительность жизни десятикратно.[5][6]
Генетические модификации у других видов не достигли такого значительного увеличения продолжительности жизни, как это было для C. elegans. Drosophila melanogaster продолжительность жизни увеличена вдвое.[7] Генетические мутации у мышей могут увеличить максимальную продолжительность жизни до 1,5 раз от нормы и до 1,7 раз от нормы в сочетании с ограничение калорий.[8]
В дрожжах, НАД + -зависимая гистондеацетилаза Sir2 необходима для геномного сайленсинга в трех локусах: дрожжевом спаривании места, то теломеры и рибосомная ДНК (рДНК). У некоторых видов дрожжей репликативное старение может быть частично вызвано: гомологичная рекомбинация между повторами рДНК; иссечение повторов рДНК приводит к образованию круги внехромосомной рДНК (ERC). Эти ERC реплицируются и предпочтительно отделяются от материнской клетки во время клеточного деления и, как полагают, приводят к клеточному старению за счет титрование далеко (соревнуясь за) существенное ядерные факторы. ERC не наблюдались у других видов (и даже у всех штаммов одного и того же вида дрожжей) дрожжей (которые также демонстрируют репликативное старение), и считается, что ERC не способствуют старению у высших организмов, таких как люди (они не были показаны накапливаться в организме млекопитающих аналогично дрожжам). Внехромосомная кольцевая ДНК (экДНК) была обнаружена у червей, мух и людей. Происхождение и роль эккДНК в старении, если таковая имеется, неизвестны.
Несмотря на отсутствие связи между кольцевой ДНК и старением у высших организмов, дополнительные копии Sir2 способны продлевать продолжительность жизни как червей, так и мух (хотя у мух это открытие не было воспроизведено другими исследователями, и активатор Sir2 ресвератрол не увеличивает воспроизводимо продолжительность жизни ни у одного вида.[9]Неясно, играют ли гомологи Sir2 у высших организмов какую-либо роль в продолжительности жизни, но было продемонстрировано, что белок SIRT1 человека способен деацетилат p53, Ku70 и вилка семья факторы транскрипции. SIRT1 может также регулировать ацетилаты, такие как CBP / p300, и было показано, что он деацетилирует определенные гистон остатки.
RAS1 и RAS2 также влияют на старение дрожжей и имеют человеческого гомолога. Было показано, что сверхэкспрессия RAS2 увеличивает продолжительность жизни дрожжей.
Другие гены регулируют старение дрожжей, повышая устойчивость к окислительный стресс. Супероксиддисмутаза, а белок что защищает от воздействия митохондриальный свободный радикалы, может увеличить продолжительность жизни дрожжей в стационарной фазе при сверхэкспрессии.
У высших организмов старение, вероятно, частично регулируется посредством пути инсулин / IGF-1. Мутации, влияющие на инсулиноподобная передача сигналов у червей, мух и оси гормона роста / IGF1 у мышей связаны с увеличенной продолжительностью жизни. В дрожжах активность Sir2 регулируется никотинамидазой PNC1. PNC1 транскрипционно усиленный в стрессовых условиях, таких как ограничение калорий, тепловой удар, и осмотический шок. Преобразовав никотинамид к ниацин, никотинамид удаляется, подавляя активность Sir2. А никотинамидаза найден у людей, известный как PBEF, может выполнять аналогичную функцию, и секретируемая форма PBEF, известная как висфатин может помочь отрегулировать сыворотку инсулин уровни. Однако неизвестно, существуют ли эти механизмы и у людей, поскольку существуют очевидные различия в биологии между людьми и модельными организмами.
Было показано, что активность Sir2 увеличивается при ограничении калорийности. Из-за нехватки доступной глюкозы в клетках доступно больше NAD +, которое может активировать Sir2. Ресвератрол, стильбеноид, обнаруженный в коже красного виноград, как сообщалось, продлевает продолжительность жизни дрожжей, червей и мух (увеличение продолжительности жизни мух и червей оказалось невоспроизводимым независимыми исследователями[9]). Было показано, что он активирует Sir2 и, следовательно, имитирует эффекты ограничения калорий, если принять, что ограничение калорий действительно зависит от Sir2.
Согласно базе данных генов, связанных со старением GenAge, существует более 1800 генов, изменяющих продолжительность жизни в модельные организмы: 838 в почве аскариды (Caenorhabditis elegans ), 883 в дрожжах хлебопекарных (Saccharomyces cerevisiae ), 170 у плодовой мушки (Drosophila melanogaster ) и 126 в мышке (Mus musculus ).[10]
Ниже приводится список генов, связанных с долголетием в результате исследований. [10] на модельные организмы:
| Подоспора | Сахаромицеты | Caenorhabditis | Дрозофила | Mus |
|---|---|---|---|---|
| гризея | LAG1 | daf-2 | sod1 | Опора-1 |
| LAC1 | возраст-1 /daf-23 | cat1 | p66shc (Независимая проверка не подтверждена) | |
| яма-1 | Ghr | |||
| RAS1 | daf-18 | мес | mclk1 | |
| RAS2 | акт-1 /акт-2 | |||
| PHB1 | daf-16 | |||
| PHB2 | daf-12 | |||
| CDC7 | ctl-1 | |||
| BUD1 | старый-1 | |||
| РИТЭГ2 | SPE-26 | |||
| RPD3 | clk-1 | |||
| HDA1 | мэв-1 | |||
| SIR2 | ||||
| ААК-2 | ||||
| SIR4-42 | ||||
| UTH4 | ||||
| YGL023 | ||||
| SGS1 | ||||
| RAD52 | ||||
| FOB1 |

В июле 2020 ученые, использующие общественные биологические данные на 1,75 млн человек с известной продолжительностью жизни определить 10 геномные локусы которые, по-видимому, внутренне влияют на продолжительность жизни, продолжительность жизни и долголетие - о половине из которых ранее не сообщалось общегеномное значение и большинство из них связано с сердечно-сосудистые заболевания - и идентифицировать метаболизм гема как перспективный кандидат для дальнейших исследований в данной области. Их исследование предполагает, что высокий уровень железа в крови, вероятно, снижается, а гены, участвующие в метаболизме железа, вероятно, увеличивают здоровые годы жизни у людей.[12][11]
Нед Шарплесс и его сотрудники продемонстрировали первую связь in vivo между экспрессией p16 и продолжительностью жизни.[13] Они обнаружили снижение экспрессии p16 в некоторых тканях мышей с мутациями, увеличивающими продолжительность жизни, а также у мышей, у которых продолжительность жизни увеличилась за счет ограничения в еде. Ян ван Дерсен и Даррен Бейкер в сотрудничестве с Андре Терзичем на Клиника Майо в Рочестере, штат Миннесота, предоставили первые доказательства in vivo причинной связи между клеточным старением и старением, предотвращая накопление стареющих клеток у прогероидных мышей BubR1.[14] В отсутствие стареющих клеток в тканях мышей наблюдалось значительное улучшение обычного бремени возрастных расстройств. Они не развивались катаракта, избежал обычного истощения мышц с возрастом. Они удерживают в коже жировые слои, которые с возрастом обычно истончаются и у людей вызывают появление морщин. Второе исследование, проведенное Яном ван Дерсеном в сотрудничестве с командой сотрудников из клиники Майо и Университета Гронингена, предоставило первое прямое доказательство in vivo того, что клеточное старение вызывает признаки старения за счет удаления стареющих клеток из прогероидных мышей путем введения лекарственно-индуцируемого suicide gen, а затем лечение мышей препаратом для избирательного уничтожения стареющих клеток, в отличие от уменьшения p16 всего тела.[15] Другое исследование Mayo, проведенное Джеймсом Киркландом в сотрудничестве со Скриппсом и другими группами, продемонстрировало, что сенолитики, лекарства, нацеленные на стареющие клетки, улучшают сердечную функцию и улучшают реактивность сосудов у старых мышей, уменьшают нарушение походки, вызванное излучением у мышей, и задерживают ослабление и неврологическую дисфункцию. и остеопороз у прогероидных мышей. Открытие сенолитических препаратов было основано на подходе, основанном на гипотезах: исследователи использовали наблюдение, что стареющие клетки устойчивы к апоптозу, чтобы обнаружить, что в этих клетках активизируются пути выживания. Они продемонстрировали, что эти пути выживания являются «ахиллесовой пятой» стареющих клеток, используя подходы РНК-интерференции, включая пути, связанные с Bcl-2-, AKT-, p21- и тирозинкиназой. Затем они использовали лекарственные препараты, которые, как известно, нацелены на идентифицированные пути, и показали, что эти препараты убивают стареющие клетки путем апоптоза в культуре и снижают нагрузку стареющих клеток во многих тканях in vivo. Важно отметить, что эти препараты оказывали долгосрочное действие после однократной дозы, соответствующее удалению стареющих клеток, а не временному эффекту, требующему постоянного присутствия препаратов. Это было первое исследование, которое показало, что очищение стареющих клеток улучшает функцию у мышей в хронологическом возрасте.[16]
Смотрите также
Рекомендации
- ^ Класс MR (1983). «Метод выделения мутантов долголетия у нематоды Caenorhabditis elegans и первые результаты». Механизмы старения и развития. 22 (3–4): 279–286. Дои:10.1016/0047-6374(83)90082-9. PMID 6632998.
- ^ Фридман ДБ, Джонсон Т.Е. (1988). «Мутация в гене age-1 у Caenorhabditis elegans продлевает жизнь и снижает фертильность гермафродитов» (PDF ). Генетика. 118 (1): 75–86. ЧВК 1203268. PMID 8608934.
- ^ Готтлиб С, Рувкун Г (1994). «daf-2, daf-16 и daf-23: генетически взаимодействующие гены, контролирующие формирование Дауэра у Caenorhabditis elegans». Генетика (журнал) АGenetics. 137 (1): 107–120. ЧВК 1205929. PMID 8056303.
- ^ а б Кеньон С., Чанг Дж., Генш Э., Руднер А., Табтианг Р. (1993). «Мутант C. elegans, который живет вдвое дольше, чем дикий тип». Природа. 366 (6454): 461–464. Дои:10.1038 / 366461a0. PMID 8247153.
- ^ Ayyadevara S, Alla R, Thaden JJ, Shmookler Reis RJ (2008). «Замечательное долголетие и стрессоустойчивость нематодных мутантов PI3K-null». Ячейка старения. 7 (1): 13–22. Дои:10.1111 / j.1474-9726.2007.00348.x. PMID 17996009. S2CID 2470599.
- ^ Шмуклер Рейс Р.Дж., Бхарилл П., Тазирслан С., Айядевара С. (2009). «Мутации с очень долгим сроком жизни управляют подавлением множественных сигнальных путей». Biochimica et Biophysica Acta. 1790 (10): 1075–1083. Дои:10.1016 / j.bbagen.2009.05.011. ЧВК 2885961. PMID 19465083.
- ^ Татарский М., Копельман А., Эпштейн Д., Ту М.П., Инь С.М., Гарофало Р.С. (1988). «Мутантный гомолог рецептора инсулина дрозофилы, который увеличивает продолжительность жизни и нарушает нейроэндокринную функцию». Наука. 292 (5514): 107–110. Дои:10.1126 / science.1057987. PMID 11292875.
- ^ Бартке А., Райт Дж. С., Мэттисон Дж. А., Инграм Д. К., Миллер Р. А., Рот Г. С. (2001). «Увеличение продолжительности жизни мышей-долгожителей» (PDF). Природа. 414 (6862): 412. Дои:10.1038/35106646. HDL:2027.42/62803. PMID 11719795.
- ^ а б Бас TM; Weinkove D; Houthoofd K; Самоцветы D; Куропатка Л. (октябрь 2007 г.). «Влияние ресвератрола на продолжительность жизни у Drosophila melanogaster и Caenorhabditis elegans». Механизмы старения и развития. 128 (10): 546–52. Дои:10.1016 / j.mad.2007.07.007. PMID 17875315.
- ^ а б «База данных GenAge». Получено 26 февраля 2011.
- ^ а б Тиммерс, Пол Р. Х. Дж .; Уилсон, Джеймс Ф .; Джоши, Питер К .; Дилен, Джорис (16 июля 2020 г.). «Многофакторное геномное сканирование позволяет выявить новые локусы и метаболизм гема в процессе старения человека». Nature Communications. 11 (1): 1–10. Дои:10.1038 / s41467-020-17312-3. ISSN 2041-1723. Получено 18 августа 2020.
 Текст и изображения доступны под Международная лицензия Creative Commons Attribution 4.0.
Текст и изображения доступны под Международная лицензия Creative Commons Attribution 4.0. - ^ «Уровни железа в крови могут быть ключом к замедлению старения, как показывают исследования генов». Phys.org. Получено 18 августа 2020.
- ^ Кришнамурти, Дж; Торрис, К; Рэмси, MR; Ковалев Г.И.; Al-Regaiey, K; Вс, л; Шарплесс, NE (2004). «Экспрессия Ink4a / Arf является биомаркером старения». J. Clin. Вкладывать деньги. 114 (9): 1299–1307. Дои:10.1172 / JCI22475. ЧВК 524230. PMID 15520862.
- ^ Бейкер DJ; Давлати ММ; Wijshake T; Джеганатан КБ; Malureanu L; van Ree JH; Креспо-Диаз Р; Рейес С; Сибург L; Шапиро В; Бехфар А; Terzic A; ван де Слуис Б; ван Дерсен JM (январь 2013 г.). «Повышенная экспрессия BubR1 защищает от анеуплоидии и рака и продлевает здоровую жизнь». Nat Cell Biol. 15 (1): 96–102. Дои:10.1038 / ncb2643. ЧВК 3707109. PMID 23242215.
- ^ Baker, D .; Wijshake, T .; Tchkonia, T .; LeBrasseur, N .; Чайлдс, B .; van de Sluis, B .; Kirkland, J .; ван Дерсен, Дж. (10 ноября 2011 г.). «Удаление p16Ink4a-позитивных стареющих клеток задерживает связанные со старением расстройства». Природа. 479 (7372): 232–6. Дои:10.1038 / природа10600. ЧВК 3468323. PMID 22048312.
- ^ Чжу, Y; Чкония, Т; Пирцхалава, Т; Гауэр, переменного тока; Дин, Н; Гиоргадзе, Н; Палмер, АК; Икено, Y; Хаббард, Великобритания; Ленбург, М; О'Хара, СП; Ла-Руссо, NF; Миллер, JD; Роос, СМ; Verzosa, GC; LeBrasseur, NK; Wren, JD; Фарр, JN; Хосла, S; Стаут, МБ; Макгоуэн, SJ; Fuhrmann-Stroissnigg, H; Гуркар, Австралия; Чжао, Дж; Коланджело, Д; Дорронсоро, А; Линг, ГГ; Barghouthy, AS; Наварро, округ Колумбия; Сано, Т; Роббинс, PD; Niedernhofer, LJ; Киркланд, JL (9 марта 2015 г.). «Ахиллесова пята стареющих клеток: от транскриптома до сенолитических препаратов». Ячейка старения. 14 (4): 644–58. Дои:10.1111 / acel.12344. ЧВК 4531078. PMID 25754370.
внешняя ссылка
- Геномные ресурсы старения человека, набор баз данных и инструментов, призванных помочь исследователям изучать генетику старения человека.
- База данных NetAge, онлайн-база данных и инструменты сетевого анализа для биогеронтологических исследований
