Морская пищевая сеть - Marine food web

По сравнению с земной средой, морская среда пирамиды биомассы которые перевернуты у основания. В частности, биомасса потребителей (веслоногие рачки, криль, креветки, кормовая рыба) больше, чем биомасса первичные производители. Это происходит потому, что основные производители океана крошечные. фитопланктон которые быстро растут и воспроизводятся, поэтому небольшая масса может иметь высокую скорость основное производство. Напротив, многие крупные наземные первичные производители, такие как зрелые леса, растут и воспроизводятся медленно, поэтому для достижения той же скорости первичной продукции требуется гораздо большая масса.
Из-за этой инверсии это зоопланктон которые составляют большую часть морских животных биомасса. В качестве основные потребители, зоопланктон является решающим связующим звеном между основными продуцентами (в основном фитопланктоном) и остальной частью морская пищевая сеть (вторичные потребители ).[1]
Если фитопланктон умирает до того, как его съели, он опускается через эвфотическая зона как часть морской снег и поселяется в морских глубинах. Таким образом, фитопланктон улавливает около 2 миллиардов тонн углекислого газа в океан каждый год, в результате чего океан становится стоком углекислого газа, содержащего около 90% всего улавливаемого углерода.[2] Океан производит около половины мирового кислорода и хранит в 50 раз больше углекислого газа, чем атмосфера.[3]
Экосистему нельзя понять без знания того, как ее пищевая сеть определяет поток материалов и энергии. Фитопланктон автотрофно производит биомассу путем преобразования неорганические соединения в органический ед. Таким образом, фитопланктон функционирует как основа морской пищевой сети, поддерживая все остальные живые существа в океане. Второй центральный процесс в морской пищевой сети - это микробная петля. Этот цикл деградирует морские бактерии и археи, реминерализует органические и неорганические вещества, а затем перерабатывают продукты либо в пелагической пищевой сети, либо путем осаждения их в виде осадка на морском дне.[4]
Пищевые цепи и трофические уровни
| морская пищевая цепь (типичный) |
|---|
| ↓ |
| фитопланктон |
| ↓ |
| травоядный зоопланктон |
| ↓ |
| хищный зоопланктон |
| ↓ |
| ↓ |
Пищевые полотна построены из пищевые цепи. Все формы жизни в море могут стать пищей для другой формы жизни. В океане пищевая цепь обычно начинается с энергии солнца. фитопланктон, и следует таким курсом, как:
фитопланктон → растительноядный зоопланктон → плотоядный зоопланктон → питатель фильтра → хищное позвоночное
Фитопланктон им в пищу не нужны другие организмы, потому что они способны производить себе пищу непосредственно из неорганического углерода, используя солнечный свет в качестве источника энергии. Этот процесс называется фотосинтез, и приводит к тому, что фитопланктон превращает природный углерод в протоплазма. По этой причине считается, что фитопланктон первичные производители на нижнем или первом уровне морской пищевой цепи. Поскольку они находятся на первом уровне, говорят, что у них есть трофический уровень из 1 (из Греческий трофеи имеется в виду еда). Затем фитопланктон потребляется на следующем трофическом уровне пищевой цепи микроскопическими животными, называемыми зоопланктоном.
Зоопланктон составляют второй трофический уровень пищевой цепи и включают микроскопические одноклеточные организмы, называемые простейшие а также маленькие ракообразные, Такие как копеподы и криль, а личинка рыбы, кальмаров, омаров и крабов. Организмы на этом уровне можно рассматривать как основные потребители.
В свою очередь, более мелкий растительноядный зоопланктон потребляется более крупными хищными зоопланктонами, такими как более крупные хищные простейшие и криль, и по кормовая рыба, которые маленькие, учеба в школе, фильтрующий рыбы. Это составляет третий трофический уровень пищевой цепи.
Четвертый трофический уровень состоит из хищная рыба, морские млекопитающие и морские птицы которые потребляют кормовую рыбу. Примеры рыба-меч, уплотнения и олуши.
Высшие хищники, такие как косатки, который может поглотить уплотнения, и короткопёрые акулы мако, которые могут потреблять рыбу-меч, составляют пятый трофический уровень. Усатые киты могут напрямую потреблять зоопланктон и криль, что приводит к пищевой цепочке с тремя или четырьмя трофическими уровнями.
На практике трофические уровни обычно не простые целые числа потому что один и тот же вид потребителей часто питается более чем на одном трофическом уровне.[8][9] Например большой морское позвоночное животное может есть более мелкую хищную рыбу, но также может есть фильтраторы; то морской скат ест ракообразные, но молот питается как ракообразными, так и скатами. Животные тоже могут есть друг друга; то треска ест треску меньшего размера, а также рак, а раки поедают личинок трески. Пищевые привычки молодняка и, как следствие, его трофический уровень могут изменяться по мере взросления.
Ученый-рыболов Дэниел Поли устанавливает значения трофических уровней на единицу в первичных продуцентах и детрит, два у травоядных и детритоядных животных (первичные потребители), три у вторичных потребителей и так далее. Определение трофического уровня TL для любого вида-потребителя:[10]
куда фракционный трофический уровень жертвы j, и представляет собой долю j в диете я. В случае морских экосистем трофический уровень большинства рыб и других морских потребителей принимает значение от 2,0 до 5,0. Верхнее значение 5.0 необычно даже для крупной рыбы,[11] хотя он встречается у высших хищников морских млекопитающих, таких как белые медведи и косатки.[12] Для сравнения, у людей средний трофический уровень составляет около 2,21, что примерно соответствует уровню свиньи или анчоуса.[13][14]
По таксону
Первичные производители
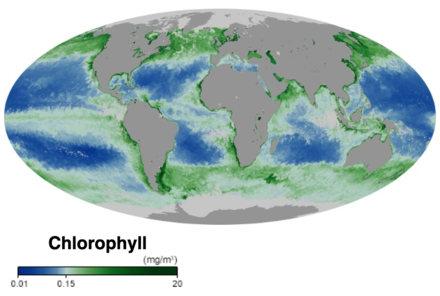
В основе пищевой сети океана лежат одноклеточные водоросли и другие растительные организмы, известные как фитопланктон. Фитопланктон, как и растения на суше, использует хлорофилл и другие светособирающие пигменты выполнять фотосинтез, поглощая атмосферный углекислый газ для производства сахаров для топлива. Хлорофилл в воде изменяет то, как вода отражает и поглощает солнечный свет, что позволяет ученым наносить на карту количество и расположение фитопланктона. Эти измерения дают ученым ценную информацию о состоянии окружающей среды океана и помогают ученым изучать углеродный цикл океана.[15]
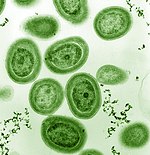
Среди фитопланктона есть представители типа бактерий, называемых цианобактерии. Морские цианобактерии включают мельчайшие из известных фотосинтезирующих организмов. Самый маленький из всех, Прохлорококк, составляет всего от 0,5 до 0,8 мкм в поперечнике.[16] Что касается индивидуальных номеров, Прохлорококк возможно, самый многочисленный вид на Земле: один миллилитр поверхностной морской воды может содержать 100 000 клеток или больше. По оценкам, во всем мире существует несколько октиллион (1027) лиц.[17] Прохлорококк встречается повсеместно между 40 ° с.ш. и 40 ° ю.ш. и доминирует в олиготрофный (бедные питательными веществами) регионы океанов.[18] Бактерия составляет около 20% кислорода в атмосфере Земли.[19]
- Фитопланктон составляет основу пищевой цепи океана

Фитопланктон

Динофлагеллята

Диатомеи
В океанах большинство основное производство выполняется водоросли. Это контрастирует с землей, где основная часть первичного производства осуществляется сосудистые растения. Водоросли варьируются от одиночных плавающих клеток до прикрепленных водоросли, а сосудистые растения представлены в океане такими группами, как морские травы и мангровые заросли. Более крупные производители, такие как морская трава и водоросли, в основном ограничиваются прибрежный зона и мелководье, где они прикреплять к нижележащему субстрату и все еще находятся в световая зона. Но большая часть первичной продукции водорослей осуществляется фитопланктоном.
Таким образом, в условиях океана первый трофический уровень дна занят преимущественно фитопланктон, микроскопические дрейфующие организмы, в основном одноклеточный водоросли, что плавают в море. Большинство фитопланктона слишком малы, чтобы их можно было увидеть отдельно. невооруженный глаз. Они могут проявляться в виде (часто зеленого) обесцвечивания воды, когда они присутствуют в достаточно большом количестве. Поскольку они увеличивают свою биомассу в основном за счет фотосинтеза, они живут в освещенном солнцем поверхностном слое (эвфотическая зона ) моря.
К важнейшим группам фитопланктона относятся: диатомеи и динофлагелляты. Диатомовые водоросли особенно важны в океанах, где, по некоторым оценкам, они вносят до 45% первичной продукции океана.[20] Диатомеи обычно микроскопический, хотя некоторые виды могут достигать в длину до 2 миллиметров.
Основные потребители
Второй трофический уровень (основные потребители ) занята зоопланктон которые питаются фитопланктон. Вместе с фитопланктоном они составляют основу пищевой пирамиды, которая поддерживает большинство крупных рыболовных угодий мира. Зоопланктон - это крошечные животные, обитающие вместе с фитопланктоном в океанический поверхностные воды и включить крошечный ракообразные, личинки рыб и жарить (недавно вылупившаяся рыба). Большинство зоопланктона питатели-фильтры, и они используют придатки, чтобы напрячь фитопланктон в воде. Некоторый более крупный зоопланктон также питается меньшим зоопланктоном. Некоторые зоопланктоны могут немного прыгать, чтобы избежать хищников, но они не умеют плавать. Как и фитопланктон, они плавают вместе с течениями, приливами и ветрами. Зоопланктон может быстро воспроизводиться, при благоприятных условиях их популяция может увеличиваться до тридцати процентов в день. Многие живут короткой и продуктивной жизнью и быстро достигают зрелости.
- Зоопланктон формирует второй уровень пищевой цепи океана.

Сегментированный червь

Крошечные креветочные ракообразные
Молодь планктонных кальмаров
Особо важными группами зоопланктона являются копеподы и криль. Копеподы группа маленьких ракообразные найдено в океане и пресная вода среда обитания. Это самый большой источник белка в море,[21] и являются важной добычей для кормовой рыбы. Криль составляют следующий по величине источник белка. Криль - это особенно крупный зоопланктон-хищник, который питается зоопланктоном меньшего размера. Это означает, что они действительно относятся к третьему трофическому уровню, вторичным потребителям наряду с кормовой рыбой.

Вместе, фитопланктон и зоопланктон составляют большую часть планктон в море. Планктон - это термин, применяемый к любому небольшому дрейфу. организмы что плывут в море (Греческий планктос = странник или бродяга). По определению организмы, классифицируемые как планктон, не могут плавать против океанских течений; они не могут противостоять окружающему току и контролировать свое положение. В условиях океана первые два трофических уровня занимают в основном планктон. Планктон делится на производителей и потребителей. Производителями являются фитопланктон (греч. фитон = растение), а потребителями, которые поедают фитопланктон, является зоопланктон (греч. зун = животное).
Медуза медленно плавают, и большинство видов составляют часть планктона. Традиционно медузы рассматривались как трофические тупики, второстепенные игроки в морской пищевой сети, студенистые организмы с план тела в значительной степени основан на воде, которая не представляет большой питательной ценности или интереса для других организмов, за исключением нескольких специализированных хищников, таких как океанская солнечная рыба и кожистая морская черепаха.[23][22] Это мнение недавно было оспорено. Медузы и вообще студенистый зоопланктон который включает в себя сальпы и гребневики, очень разнообразны, хрупки, не имеют твердых частей, трудны для наблюдения и наблюдения, подвержены быстрым колебаниям численности населения и часто живут неудобно вдали от берега или глубоко в океане. Ученым сложно обнаружить и проанализировать медуз в кишечнике хищников, так как они превращаются в кашу при поедании и быстро перевариваются.[23] Но медузы цветут в огромных количествах, и было показано, что они составляют основные компоненты в рационе тунец, подводная рыба и рыба-меч а также различных птиц и беспозвоночных, таких как осьминог, морские огурцы, крабы и амфиподы.[24][22] «Несмотря на низкую плотность энергии, вклад медуз в энергетический баланс хищников может быть намного больше, чем предполагалось, из-за быстрого пищеварения, низких затрат на вылов, доступности и избирательного питания более богатыми энергией компонентами. морские хищники восприимчивы к проглатыванию пластмасс ».[22]
Потребители высшего порядка

- Морские беспозвоночные
- Рыбы
- Кормовая рыба: Кормовая рыба занимает центральное место в океане. пищевые полотна. Организмы, которые он ест, находятся на более низком уровне трофический уровень, а организмы, которые его поедают, находятся на более высоком трофическом уровне. Кормовые рыбы занимают средние уровни пищевой сети, выступая в качестве основной добычи для более высоких рыб, морских птиц и млекопитающих.[25]
- Рыба-хищник
- Молотая рыба
- Другие морские позвоночные
В 2010 году исследователи обнаружили, что киты переносят питательные вещества из глубин океана обратно на поверхность с помощью процесса, который они назвали китовый насос.[26] Киты питаются на более глубоких уровнях океана, где криль обнаружен, но регулярно возвращаются на поверхность, чтобы дышать. Там киты испражняться жидкость богат азотом и железом. Вместо того, чтобы тонуть, жидкость остается на поверхности, где фитопланктон потребляйте это. В заливе Мэн китовый насос обеспечивает больше азота, чем реки.[27]

Горбатые киты выпад снизу кормить кормовой рыбой

Олуши окунуться в воду сверху ловить кормовую рыбу
 Китовый насос цикл питательных веществ
Китовый насос цикл питательных веществ
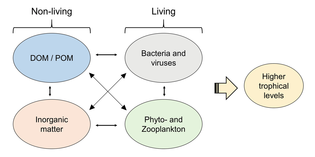
Микроорганизмы

В последние годы растет признание того, что морские микроорганизмы играют гораздо большую роль в морских экосистемах, чем считалось ранее. События в метагеномика дает исследователям возможность выявить ранее скрытые многообразия микроскопической жизни, предлагая мощный объектив для наблюдения за микробным миром и возможность революционизировать понимание живого мира.[29] Метабаркодирование диетического анализа методы используются для реконструкции трофических сетей на более высоких уровнях таксономического разрешения и выявляют более глубокие сложности в сети взаимодействий.[30]
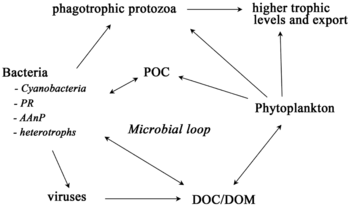
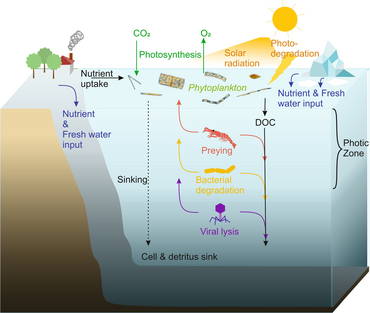
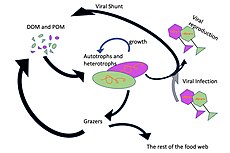
Микроорганизмы играют ключевую роль в морских пищевых сетях. В вирусный шунт путь - это механизм, предотвращающий морские микробные твердое органическое вещество (POM) от перехода вверх трофические уровни переработав их в растворенное органическое вещество (DOM), которые легко усваиваются микроорганизмами.[31] Вирусное шунтирование помогает поддерживать разнообразие в микробной экосистеме, предотвращая доминирование одного вида морских микробов в микросреде.[32] РОВ, рециркулируемое путем вирусного шунтирования, сопоставимо с количеством, вырабатываемым другими основными источниками морского РОВ.[33]
В целом, растворенный органический углерод (DOC) попадает в окружающую среду океана в результате бактериального лизиса, утечки или экссудации фиксированного углерода из фитопланктона (например, слизистого экзополимера из диатомеи ), внезапное старение клеток, неаккуратное питание зоопланктоном, выделение продуктов жизнедеятельности водными животными или разложение или растворение органических частиц наземных растений и почв.[34] Бактерии в микробная петля разложите этот твердый обломок, чтобы использовать это богатое энергией вещество для роста. Поскольку более 95% органического вещества в морских экосистемах состоит из полимерных материалов с высоким содержанием молекулярный вес (HMW) соединения (например, белок, полисахариды, липиды), только небольшая часть от общего растворенное органическое вещество (DOM) легко утилизируется большинством морских организмов на более высоких трофических уровнях. Это означает, что растворенный органический углерод недоступен для большинства морских организмов; морские бактерии вносят этот органический углерод в пищевую сеть, в результате чего дополнительная энергия становится доступной для более высоких трофических уровней.
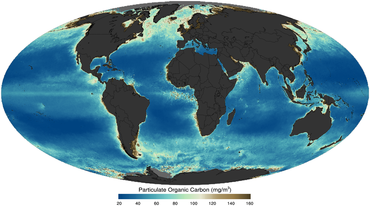
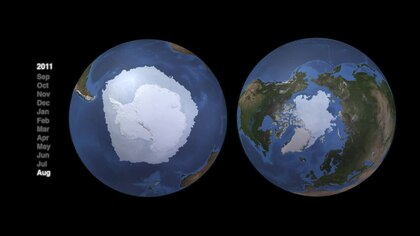
в качестве изображение со спутника в 2011


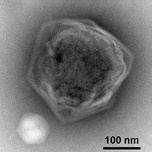
Гигантский морской вирус CroV заражает и вызывает смерть лизис морской зоофлагелляты Кафетерий roenbergensis.[38] Это влияет на экологию побережья, потому что Кафетерий roenbergensis питается бактериями, обнаруженными в воде. Когда мало Кафетерий roenbergensis из-за обширных инфекций CroV популяция бактерий увеличивается в геометрической прогрессии.[39] Влияние CroV на естественных популяциях С. roenbergensis остается неизвестным; однако было обнаружено, что вирус очень специфичен для хозяина и не заражает другие близкородственные организмы.[40] Cafeteria roenbergensis также инфицировано вторым вирусом, Мавирусный вирофаг, который является спутниковый вирус, что означает, что он может реплицироваться только в присутствии другого специфического вируса, в данном случае в присутствии CroV.[41] Этот вирус препятствует репликации CroV, что приводит к выживанию С. roenbergensis клетки. Мавирус способен интегрироваться в геном клеток С. roenbergensis, и тем самым обеспечить неприкосновенность населения.[42]
Грибы

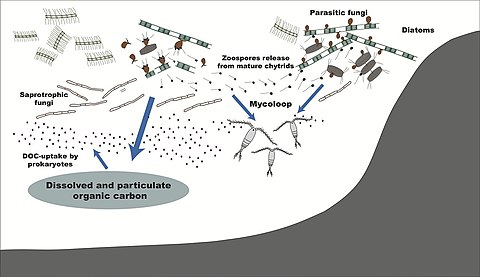
По среде обитания
Пелагические сети
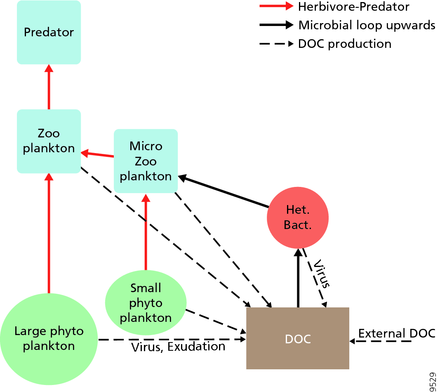
Для пелагических экосистем Лежандр и Расулзадаган предложили в 1995 г. континуум трофических путей с пищевой цепью травоядных и микробная петля как конечные участники пищевой сети.[47] Классический линейный конечный член пищевой цепи включает выпас зоопланктона на более крупном фитопланктоне и последующее нападение на зоопланктон более крупного зоопланктона или другого хищника. В такой линейной пищевой цепи хищник может либо привести к высокому уровню фитопланктона. биомасса (в системе с фитопланктоном, травоядным и хищником) или уменьшенной биомассой фитопланктона (в системе с четырьмя уровнями). Таким образом, изменения численности хищников могут привести к трофические каскады.[48] Конечный член микробной петли включает в себя не только фитопланктон как основной ресурс, но и растворенный органический углерод.[49] Растворенный органический углерод используется гетеротрофными бактериями для роста, которому предшествует более крупный зоопланктон. Следовательно, растворенный органический углерод через петлю бактерий-микрозоопланктон превращается в зоопланктон. Эти два конечных элемента обработки углерода связаны на нескольких уровнях. Мелкий фитопланктон может напрямую потребляться микрозоопланктоном.[46]
Как показано на диаграмме справа, растворенный органический углерод производится разными способами и различными организмами, как первичными производителями, так и потребителями органического углерода. Высвобождение DOC первичными продуцентами происходит пассивно за счет утечки и активно во время несбалансированного роста при ограничении питательных веществ.[50][51] Другой прямой путь от фитопланктона к растворенному органическому бассейну включает: вирусный лизис.[52] Морские вирусы являются основной причиной гибели фитопланктона в океане, особенно в более теплых водах низких широт. Небрежное кормление другими источниками растворенного органического углерода являются травоядные животные и неполное переваривание добычи потребителями. Гетеротрофные микробы используют внеклеточные ферменты для растворения органический углерод в виде твердых частиц и использовать этот и другие ресурсы растворенного органического углерода для роста и поддержания. Часть микробной гетеротрофной продукции используется микрозоопланктоном; другая часть гетеротрофного сообщества подвергается интенсивному вирусному лизису, что снова вызывает высвобождение растворенного органического углерода. Эффективность микробной петли зависит от множества факторов, но, в частности, от относительной важности хищничества и вирусного лизиса для смертности гетеротрофных микробов.[46]
- Пелагическая пищевая сеть

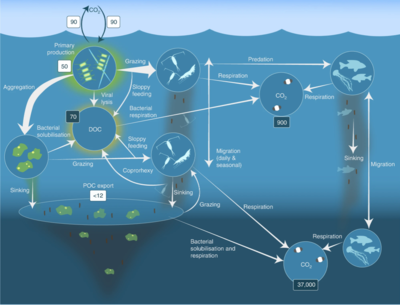
Пелагическая пищевая сеть и биологический насос. Связь между биологическим насосом океана и пелагической пищевой цепью, а также возможность удаленного отбора проб этих компонентов с кораблей, спутников и автономных транспортных средств. Голубые воды - это эвфотическая зона, а более темные синие воды представляют зона сумерек.[53]
- Мезопелагическая пищевая сеть

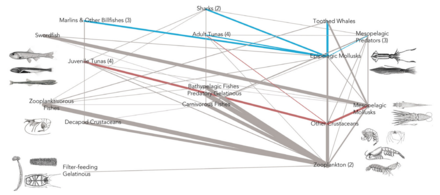
Влияние мезопелагических видов на глобальный углеродный бюджет[54]
DVM = diel вертикальная миграция NM = без миграции

Мезопелагический щетинистый рот могут быть самыми многочисленными позвоночными на планете, хотя о них мало что известно.[55]

Студенистые хищники так наркомедузан потребляют наибольшее разнообразие мезопелагической добычи
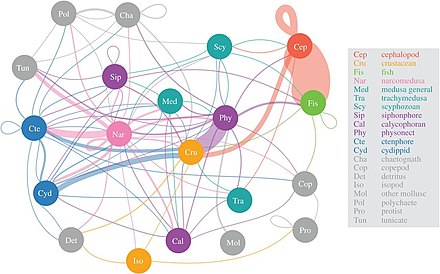
Ученые начинают более подробно исследовать малоизвестную сумеречную зону мезопелагический, Глубиной от 200 до 1000 метров. Этот слой отвечает за удаление из атмосферы около 4 миллиардов тонн углекислого газа ежегодно. В мезопелагическом слое обитает большая часть морских рыб. биомасса.[55]
Согласно исследованию 2017 года, наркомедузы потребляют наибольшее разнообразие мезопелагической добычи, за которой следуют Physonect сифонофоры, гребневики и головоногие моллюски. Важность так называемой «желейной сети» только начинает осознаваться, но кажется, что медузы, гребневики и сифонофоры могут быть ключевыми хищниками в глубоких пелагических пищевых сетях с экологическими последствиями, подобными хищным рыбам и кальмарам. Традиционно студенистые хищники считались неэффективными поставщиками морских трофических путей, но они, по-видимому, играют существенную и неотъемлемую роль в глубоких пелагических пищевых сетях.[56] Вертикальная миграция Diel, важный активный транспортный механизм, позволяет мезозоопланктон для изоляции углекислого газа из атмосферы, а также для обеспечения потребностей в углероде других мезопелагических организмов.[57]
В исследовании 2020 года сообщается, что к 2050 году глобальное потепление может распространяться в глубинах океана в семь раз быстрее, чем сейчас, даже если выбросы парниковых газов сократятся. Потепление в мезопелагический а более глубокие слои могут иметь серьезные последствия для глубоководной океанической пищевой сети, поскольку океанические виды должны будут перемещаться, чтобы оставаться при температурах выживания.[58][59]
- Рыба в сумерках проливает новый свет на экосистему океана Разговор, 10 февраля 2014 г.
- Тайна океана в триллионах Нью-Йорк Таймс, 29 июня 2015 г.
- Мезопелагические рыбы - Маласпинская кругосветная экспедиция 2010 г.[60][61]
На поверхности океана
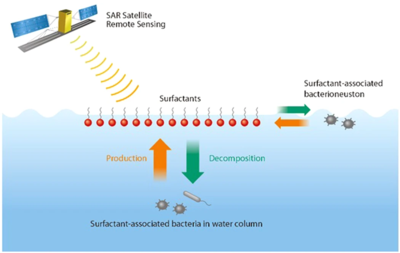
Среда обитания на поверхности океана находится на стыке океана и атмосферы. В биопленочный среда обитания на поверхности океана служит местом обитания поверхностных микроорганизмов, обычно называемых Neuston. Эта обширная граница раздела воздух-вода находится на пересечении основных процессов обмена воздух-вода, охватывающих более 70% глобальной площади поверхности. Бактерии в поверхностном микрослое океана, называемые бактерионейстон, представляют интерес в связи с практическими применениями, такими как обмен парниковых газов между воздухом и морем, производство климатически активных морских аэрозолей и дистанционное зондирование океана.[63] Особый интерес представляет производство и деградация поверхностно-активные вещества (поверхностно-активные материалы) посредством микробных биохимических процессов. Основные источники поверхностно-активных веществ в открытом океане включают фитопланктон,[64] земной сток и выпадение из атмосферы.[63]
В отличие от цветения цветных водорослей, бактерии, связанные с поверхностно-активными веществами, могут быть не видны на цветных изображениях океана. Обладая способностью обнаруживать эти «невидимые» бактерии, связанные с поверхностно-активными веществами, используя радар с синтезированной апертурой имеет огромные преимущества в любых погодных условиях, независимо от облачности, тумана или дневного света.[63] Это особенно важно при очень сильном ветре, потому что именно в этих условиях имеют место наиболее интенсивные обмены газов между воздухом и морем и образование морских аэрозолей. Таким образом, помимо цветных спутниковых изображений, спутниковые изображения SAR могут дать дополнительную информацию о глобальной картине биофизических процессов на границе между океаном и атмосферой, обмене парниковыми газами между воздухом и морем и производстве климатически активных морских аэрозолей.[63]
На дне океана
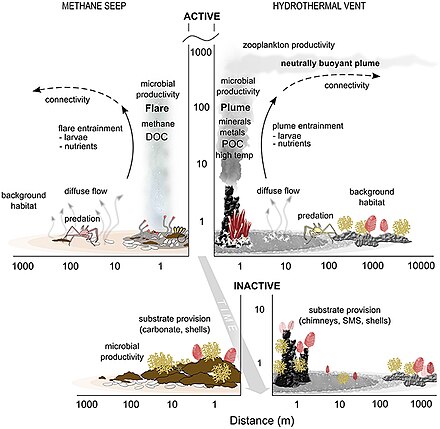
Дно океана (бентосный ) среды обитания находятся на границе между океаном и недрами земли.
- Отводы и вентиляционные отверстия
Прибрежные сети

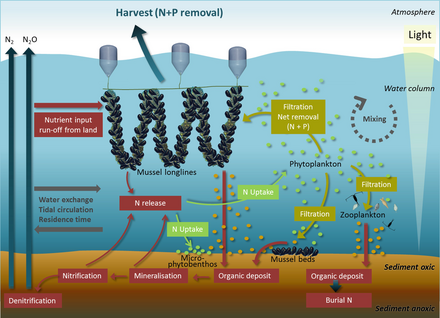
Прибрежные воды включают воды в эстуарии и более континентальные шельфы. Они занимают около 8 процентов общей площади океана.[70] и составляют около половины всей продуктивности океана.
Ключевые питательные вещества, определяющие эвтрофикация азот в прибрежных водах и фосфор в озерах. Оба обнаруживаются в высоких концентрациях в гуано (кал морских птиц), который действует как удобрение для окружающего океана или соседнего озера. Мочевая кислота является доминирующим азотным соединением, и во время его минерализации образуются различные формы азота. На диаграмме справа: (1) аммонификация дает NH3 и NH4 +, и (2) нитрификация дает NO3- за счет окисления NH4 +. В щелочных условиях, типичных для фекалий морских птиц, NH3 быстро улетучивается (3) и превращается в NH4 +, который выводится из колонии, а через влажные отложения экспортируется в отдаленные экосистемы, которые подвергаются эвтрофированию (4). Фосфорный цикл проще и имеет ограниченную подвижность. Этот элемент содержится в ряде химических форм в фекалиях морских птиц, но наиболее подвижным и биодоступным является ортофосфат, который может быть выщелоченный подземными или поверхностными водами (5).[69]

на континентальном шельфе
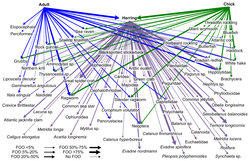
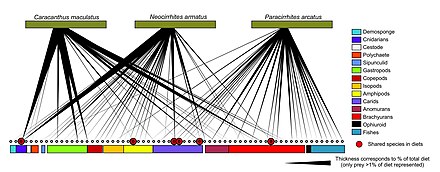
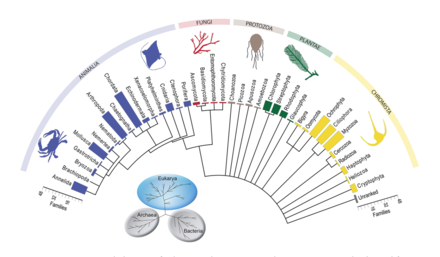
Штрих-кодирование ДНК может использоваться для построения структур пищевой сети с лучшим таксономическим разрешением в веб-узлах. Это обеспечивает более точную идентификацию видов и большую ясность в том, кто кого ест. «Штрих-коды ДНК и информация ДНК могут позволить новые подходы к построению более крупных сетей взаимодействия и преодолеть некоторые препятствия на пути к достижению адекватного размера выборки».[30]
Недавно применяемый метод идентификации видов - это метабаркодирование ДНК. Идентификация видов через морфология относительно сложно и требует много времени и опыта.[79][80] Секвенирование с высокой пропускной способностью Метабаркодирование ДНК позволяет таксономическое определение и, следовательно, идентификацию всего образца в зависимости от группы грунтовки выбран для предыдущей ДНК усиление.

- Штрих-кодирование микробной ДНК
- Штрих-кодирование ДНК водорослей
- Штрих-кодирование ДНК рыб
- Штрих-кодирование ДНК при оценке диеты
- Ламинарии леса
- Бирнс, Дж. Э., Рейнольдс, П. и Stachowicz, J.J. (2007) «Вторжения и вымирания меняют прибрежные морские пищевые сети». PLOS ONE, 2(3): e295. Дои:10.1371 / journal.pone.0000295
Полярные сети
в окружении океанов
в окружении суши
Морские системы Арктики и Антарктики очень разные. топографические сооружения и, как следствие, очень разные структуры пищевых сетей.[82] Как арктические, так и антарктические пелагические пищевые сети имеют характерные потоки энергии, контролируемые в основном несколькими ключевыми видами. Но и для них не существует единой общей сети. Альтернативные пути важны для устойчивости и поддержания потоков энергии. Однако эти более сложные альтернативы обеспечивают меньший поток энергии к видам верхнего трофического уровня. «Структура пищевой сети может быть схожей в разных регионах, но отдельные виды, которые доминируют на средних трофических уровнях, различаются в полярных регионах».[83]



- Арктический
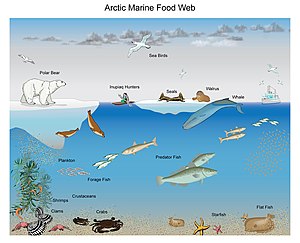
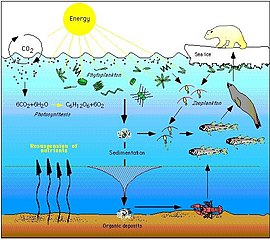
Пищевая сеть Арктики сложна. Исчезновение морского льда может в конечном итоге затронуть всю пищевую сеть, от водорослей и планктона до рыб и млекопитающих. Воздействие изменения климата на определенный вид может отражаться в пищевой сети и влиять на широкий круг других организмов ... Сокращение морского льда не только наносит ущерб популяциям белых медведей, сокращая их первичную среду обитания, но и негативно воздействуя на них через эффекты пищевой сети. Сокращение продолжительности и протяженности морского льда в Арктике приводит к снижению численности ледяных водорослей, которые процветают в богатых питательными веществами карманах во льду. Эти водоросли поедаются зоопланктоном, который, в свою очередь, поедает арктическая треска, важный источник пищи для многих морских млекопитающих, включая тюленей. Тюленей едят белые медведи. Следовательно, сокращение ледяных водорослей может способствовать сокращению популяций белых медведей.[84]
В 2020 году исследователи сообщили, что измерения за последние два десятилетия основное производство в Арктический океан показывают увеличение почти на 60% из-за более высоких концентраций фитопланктон. Они выдвигают гипотезу, что новые питательные вещества поступают из других океанов, и предполагают, что это означает, что Северный Ледовитый океан может поддерживать продукция более высокого трофического уровня и дополнительные фиксация углерода в будущем.[85][86]


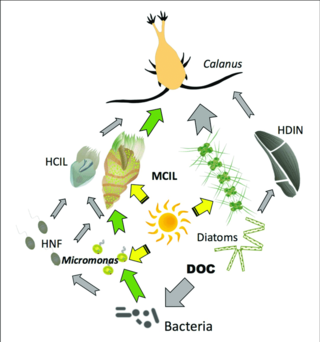
Серые стрелки: поток углерода к гетеротрофам
Зеленые стрелки: основные пути потока углерода к миксотрофам или от них.
HCIL: гетеротрофный инфузории; MCIL: миксотрофные инфузории; HNF: гетеротрофные нанофлагеллаты; DOC: растворенный органический углерод; HDIN: гетеротрофные динофлагелляты[87]

- Антарктика

Антарктическая медуза Diplulmaris antarctica подледный
Колонии водорослей Phaeocystis antarctica, важный фитопланктер моря Росса, который доминирует в начале сезона, цветет после отступления морского льда и экспортирует значительное количество углерода.[89]

В пеннат диатомовые водоросли Fragilariopsis kerguelensis, обнаруживаемый по всей Антарктическому циркумполярному течению, является ключевым двигателем глобального силикатный насос.[90]
и углеродные массы (Gt C) в темных ящиках

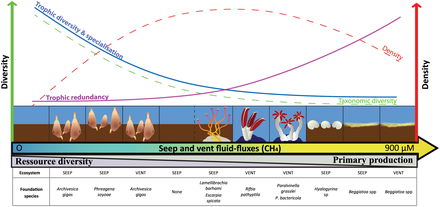
Виды фундамента и краеугольного камня



Вид основания виды, которые играют доминирующую роль в структурировании экологическое сообщество, формируя окружающую среду и определяя ее экосистему. Такие экосистемы часто называют в честь основных видов, таких как луга водорослей, устричные русла, коралловые рифы, леса водорослей и мангровые леса.[97] Например, красные мангровые заросли является обычным основным видом мангровых лесов. Корень мангрового дерева обеспечивает питательную среду для молоди рыб, таких как окунь.[98] Основной вид может занимать любой трофический уровень в пищевой сети, но, как правило, является производителем.[99]
Термин был введен в обращение в 1972 г. Пол К. Дейтон,[100] кто применил это к некоторым членам морской беспозвоночный и водоросли сообщества. Из исследований, проведенных в нескольких местах, стало ясно, что существует небольшая горстка видов, деятельность которых оказывает непропорционально большое влияние на остальную часть морского сообщества, и поэтому они являются ключом к устойчивости сообщества. По мнению Дейтона, сосредоточение внимания на основных видах позволит использовать упрощенный подход для более быстрого понимания того, как сообщество в целом отреагирует на возмущения, такие как загрязнение, вместо того, чтобы пытаться выполнять чрезвычайно сложную задачу одновременного отслеживания реакции всех членов сообщества.


Краеугольные камни - это виды, которые оказывают большое влияние, непропорциональное их численности, в пищевых сетях экосистем.[101] В экосистеме может произойти резкий сдвиг, если ключевой вид будет удален, даже если этот вид был небольшой частью экосистемы по меркам биомасса или же продуктивность.[102]
Понятие ключевого вида было введено в 1969 г. зоологом. Роберт Т. Пейн.[103][104] Пейн разработал концепцию, чтобы объяснить свои наблюдения и эксперименты по взаимосвязи между морские беспозвоночные из приливная зона (между линиями прилива и отлива), включая морская звезда и моллюски. Немного морские звезды охотятся на морские ежи, моллюски, и другие моллюски у которых нет других естественных хищников. Если морскую звезду удалить из экосистемы, популяция мидий бесконтрольно взорвется, вытеснив большинство других видов.[105]
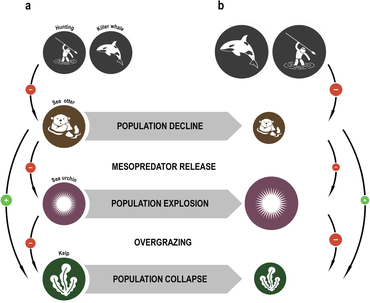
Морские выдры ограничить урон, наносимый морскими ежами ламинарии леса. Когда на каланов западного побережья Северной Америки охотились из-за их меха, их численность упала до такого низкого уровня, что они не смогли контролировать популяцию морских ежей. Ежики в свою очередь пасли удержания из ламинария настолько сильно, что леса из водорослей в значительной степени исчезли вместе со всеми видами, которые от них зависели. Повторное введение каланов позволило восстановить экосистему водорослей.[106][107]
Загадочные взаимодействия

Тайные взаимодействия, взаимодействия, которые «скрыты на виду», происходят по всей морской планктонной пищевой сети, но в настоящее время в значительной степени игнорируются установленными методами, что означает, что сбор крупномасштабных данных для этих взаимодействий ограничен. Несмотря на это, текущие данные свидетельствуют о том, что некоторые из этих взаимодействий могут оказывать ощутимое влияние на динамику пищевой сети и результаты моделирования. Включение загадочных взаимодействий в модели особенно важно для взаимодействий, связанных с переносом питательных веществ или энергии.[108]
Упрощения, такие как «зоопланктон потребляет фитопланктон», «фитопланктон поглощает неорганические питательные вещества», «валовая первичная продукция определяет количество углерода, доступного для пищевой сети» и т. Д., Помогли ученым объяснить и смоделировать общие взаимодействия в водной среде. Традиционные методы сосредоточены на количественной оценке и оценке этих обобщений, но быстрый прогресс в области геномики, пределов обнаружения сенсоров, экспериментальных методов и других технологий в последние годы показал, что обобщение взаимодействий внутри планктонного сообщества может быть слишком простым. Эти усовершенствования в технологии выявили ряд взаимодействий, которые кажутся загадочными, поскольку усилия по отбору массовых проб и экспериментальные методы направлены против них.[108]
Сложность и стабильность
Пищевые полотна обеспечивают основу, в рамках которой может быть организована сложная сеть взаимодействий хищник – жертва. Модель пищевой сети - это сеть пищевые цепи. Каждая пищевая цепочка начинается с основной производитель или же автотроф, организм, такой как водоросль или растение, способный производить себе пищу. Следующим в цепочке идет организм, который питается первичным продуцентом, и эта цепочка продолжается в виде цепочки последовательных хищников. Организмы в каждой цепи сгруппированы в трофические уровни в зависимости от того, сколько ссылок они удалены от основных производителей. Длина цепочки, или трофический уровень, является мерой количества видов, встречающихся по мере того, как энергия или питательные вещества перемещаются от растений к высшим хищникам.[111] Пищевая энергия течет от одного организма к другому, к следующему и так далее, при этом на каждом уровне теряется некоторая энергия. На данном трофическом уровне может существовать один вид или группа видов с одними и теми же хищниками и жертвами.[112]
В 1927 г. Чарльз Элтон опубликовали влиятельный синтез по использованию пищевых сетей, в результате которого они стали центральной концепцией в экологии.[113] В 1966 году интерес к пищевым сетям возрос после Роберт Пейн экспериментальное и описательное исследование приливных берегов, предполагающее, что сложность трофической сети является ключом к поддержанию видового разнообразия и экологической стабильности.[114] Многие теоретики-экологи, в том числе Роберт Мэй и Стюарт Пимм, были побуждены этим и другими открытием исследовать математические свойства пищевых сетей. Согласно их анализу, сложные пищевые сети должны быть менее стабильными, чем простые пищевые сети.[115]:75–77[116]:64 Очевидный парадокс между сложностью пищевых сетей, наблюдаемых в природе, и математической хрупкостью моделей пищевых сетей в настоящее время является областью интенсивных исследований и дискуссий. Парадокс может быть частично вызван концептуальными различиями между устойчивостью пищевой сети и равновесием. стабильность пищевой сети.[115][116]
А трофический каскад может возникнуть в пищевой сети, если трофический уровень в сети подавлен.
Например, нисходящий каскад может возникать, если хищники достаточно эффективны в борьбе с хищниками, чтобы уменьшить численность или изменить поведение своих добыча, тем самым освобождая следующий более низкий трофический уровень от хищников. Нисходящий каскад - это трофический каскад, в котором главный потребитель / хищник контролирует основной потребитель численность населения. В свою очередь, население первичных производителей процветает. Удаление главного хищника может изменить динамику пищевой сети. В этом случае первичные потребители будут перенаселенными и будут эксплуатировать первичных производителей. В конце концов, не хватит первичных производителей, чтобы поддерживать потребительское население. Стабильность нисходящей пищевой сети зависит от конкуренции и хищничества на более высоких трофических уровнях. Инвазивные виды также могут изменить этот каскад, удалив или превратившись в главного хищника. Это взаимодействие не всегда может быть отрицательным. Исследования показали, что некоторые инвазивные виды начали менять каскады; и, как следствие, была восстановлена деградация экосистемы.[117][118] Пример каскада в сложной экосистеме открытого океана произошел на северо-западе Атлантический в течение 1980-х и 1990-х годов. Удаление Атлантическая треска (Гадус Морхуа) и других донных рыб по устойчивому перелов привело к увеличению численности кормовых видов этих донных рыб, особенно мелких кормовые рыбы и беспозвоночные, такие как северные снежный краб (Chionoecetes opilio) и северный креветка (Pandalus borealis). Увеличение численности этих видов добычи изменило сообщество зоопланктон которые служат пищей для более мелких рыб и беспозвоночных в качестве косвенного эффекта.[119] Нисходящие каскады могут быть важны для понимания побочного эффекта удаления главные хищники от пищевых сетей, как это сделали люди во многих местах через охота и ловит рыбу.
В восходящем каскаде популяция первичных продуцентов всегда будет контролировать увеличение / уменьшение энергии на более высоких трофических уровнях. Первичные продуценты - растения, фитопланктон и зоопланктон, которым необходим фотосинтез. Хотя свет важен, популяции первичных продуцентов зависят от количества питательных веществ в системе. Эта пищевая сеть зависит от доступности и ограниченности ресурсов. Все популяции будут расти, если изначально имеется большое количество питательных веществ.[120][121]
Наземные сравнения

По сравнению с пирамидами наземной биомассы, водные пирамиды обычно перевернуты у основания.


Морская среда может иметь инверсии в пирамидах биомассы. В частности, биомасса потребителей (веслоногие рачки, криль, креветки, кормовая рыба) обычно больше, чем биомасса первичных продуцентов. Это происходит потому, что основными продуцентами океана являются крошечные фитопланктоны, которые r-стратег признаки быстрого роста и воспроизводства, поэтому небольшая масса может иметь высокую скорость первичного производства. Напротив, многие наземные первичные производители, такие как спелые леса, имеют К-стратег признаки медленного роста и размножения, поэтому для достижения той же скорости первичной продукции требуется гораздо большая масса. Скорость производства, деленная на среднее количество биомассы, которое достигает этой величины, называется отношением продукции организма к биомассе (P / B).[123] Производство измеряется количеством движения массы или энергии на площадь в единицу времени. Напротив, биомасса измеряется в единицах массы на единицу площади или объема. В соотношении P / B используются обратные единицы времени (например, 1 / месяц).Это соотношение позволяет оценить количество потока энергии по сравнению с количеством биомассы на заданном трофическом уровне, что позволяет проводить демаркацию между трофическими уровнями. Отношение P / B чаще всего снижается по мере увеличения трофического уровня и размера организма, при этом у небольших эфемерных организмов соотношение P / B выше, чем у крупных и долгоживущих.
Примеры: щетинистая сосна могут жить тысячи лет и имеют очень низкое соотношение продукции / биомассы. Цианобактерии Прохлорококк живет около 24 часов и имеет очень высокое соотношение продукции / биомассы.


В океанах большинство основное производство выполняется водоросли. Это контрастирует с землей, где основная часть первичного производства осуществляется сосудистые растения.
Водные продуценты, такие как планктонные водоросли или водные растения, не имеют большого скопления вторичный рост который существует в древесных деревьях наземных экосистем. Однако они могут воспроизводиться достаточно быстро, чтобы поддерживать большую биомассу пастбищных животных. Это переворачивает пирамиду. Первичные потребители имеют более длительную продолжительность жизни и более медленные темпы роста, которые накапливают больше биомассы, чем производители, которые они потребляют. Фитопланктон живет всего несколько дней, тогда как зоопланктон, питающийся фитопланктоном, живет несколько недель, а рыбы, питающиеся зоопланктоном, живут несколько лет подряд.[125] Водные хищники также имеют более низкий уровень смертности, чем более мелкие потребители, что способствует перевернутой пирамидальной структуре. Другие возможные причины образования пирамид с перевернутой биомассой - структура населения, скорость миграции и убежище для добычи в окружающей среде. Энергетические пирамиды однако всегда будет иметь форму вертикальной пирамиды, если включены все источники пищевой энергии, поскольку это продиктовано второй закон термодинамики."[126][127]
Сравнение продуктивности морских и наземных экосистем[128] | |||
|---|---|---|---|
| Экосистема | Чистая первичная производительность миллиард тонн в год | Общая биомасса растений миллиард тонн | Время оборота годы |
морской | 45–55 | 1–2 | 0.02–0.06 |
Наземный | 55–70 | 600–1000 | 9–20 |
Антропогенное воздействие
- Перелов
- Подкисление
Птероподы и хрупкие звезды вместе образуют основу Арктики пищевые полотна и оба серьезно повреждены подкислением. Раковины птероподов растворяются при увеличении закисления, а хрупкие звезды теряют мышечную массу при повторном росте придатков.[130] Кроме того, яйца хрупкой звезды погибают в течение нескольких дней при воздействии ожидаемых условий в результате подкисления Арктики.[131] Подкисление угрожает разрушить арктические пищевые сети снизу вверх. Арктические воды быстро меняются и становятся недосыщенными арагонитом.[132] Пищевые сети в Арктике считаются простыми, что означает, что в пищевой цепочке есть несколько этапов от мелких организмов до более крупных хищников. Например, крылоногие моллюски - «ключевая жертва ряда высших хищников - более крупного планктона, рыб, морских птиц, китов».[133]


- Изменение климата
«Наши результаты показывают, как будущее изменение климата может потенциально ослабить морские пищевые сети за счет снижения потока энергии на более высокие трофические уровни и перехода к системе, в большей степени основанной на детрите, что приведет к упрощению пищевой сети и изменению динамики производителей и потребителей, что имеет важное значение. последствия для структурирования бентосных сообществ ».[134][135]
"... повышенные температуры уменьшают жизненно важный поток энергии от основных производителей продуктов питания внизу (например, водорослей) к промежуточным потребителям (травоядным животным) и хищникам наверху морских пищевых сетей. Такие нарушения в передаче энергии могут потенциально привести к к уменьшению доступности пищи для высших хищников, что, в свою очередь, может привести к негативным последствиям для многих морских видов в этих пищевых сетях ... "Хотя изменение климата увеличило продуктивность растений, это произошло главным образом из-за распространения цианобактерий ( маленькие сине-зеленые водоросли), - сказал г-н Улла. - Однако такая повышенная первичная продуктивность не поддерживает пищевые сети, потому что эти цианобактерии в основном неприятны и не потребляются травоядными животными. Понимание того, как экосистемы функционируют под воздействием глобального потепления, является сложной задачей для экологических исследований. Большинство исследований потепления океана включает упрощенные краткосрочные эксперименты, основанные только на одном или нескольких видах ".[135]
Смотрите также
Рекомендации
- ^ Министерство энергетики США (2008 г.) Круговорот углерода и биосеквестрация стр. 81, отчет о семинаре DOE / SC-108, Управление науки Министерства энергетики США.
- ^ Кэмпбелл, Майк (22 июня 2011 г.). «Роль морского планктона в связывании углерода». EarthTimes. Получено 22 августа 2014.
- ^ Почему нам нужно заботиться об океане? NOAA: Национальная океаническая служба. Обновлено: 7 января 2020 г. Дата обращения 1 марта 2020 г.
- ^ Генрихс, М.Э., Мори, К., Длугош, Л. (2020) «Сложные взаимодействия между водными организмами и их химической средой, выявленные с разных точек зрения». В: Jungblut S., Liebich V., Bode-Dalby M. (Eds) YOUMARES 9-Океаны: наши исследования, наше будущее , страницы 279–297. Springer. Дои:10.1007/978-3-030-20389-4_15.
- ^ Данн, Дж. А., Уильямс, Р. Дж. и Мартинес, Н.Д. (2002) "Структура пищевой сети и теория сетей: роль взаимосвязи и размера". Труды Национальной академии наук, 99(20): 12917–12922. Дои:10.1073 / pnas.192407699.
- ^ Данн, Дж. (2006) «Сетевая структура пищевых сетей». В: M Pascual and J. A. Dunne (Eds.) Экологические сети: связь структуры с динамикой пищевых сетей, страницы 27–86. ISBN 9780199775057.
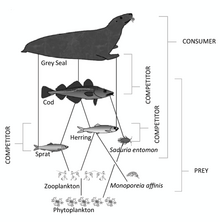
- ^ Карлсон, А.М., Горохова, Э., Гордмарк, А., Пеккан-Хеким, З., Касини, М., Альбертссон, Дж., Сунделин, Б., Карлссон, О. и Бергстрем, Л. (2020). «Связь физиологического статуса потребителя со структурой пищевой сети и пищевой ценностью добычи в Балтийском море». Ambio, 49(2): 391–406. Дои:10.1007 / s13280-019-01201-1
- ^ Одум, В. Э.; Хилд, Э. Дж. (1975) "Пищевая сеть на основе детрита сообщества устьевых мангровых зарослей". Страницы 265–286 в Л. Э. Кронине, изд. Эстуарий исследования. Vol. 1. Academic Press, Нью-Йорк.
- ^ Pimm, S.L .; Лоутон, Дж. Х. (1978). «При питании более чем на одном трофическом уровне». Природа. 275 (5680): 542–544. Дои:10.1038 / 275542a0. S2CID 4161183.
- ^ Pauly, D .; Паломарес, М. Л. (2005). «Ловля морских пищевых сетей: это гораздо более распространенное явление, чем мы думали» (PDF). Бюллетень морской науки. 76 (2): 197–211. Архивировано из оригинал (PDF) на 2013-05-14.
- ^ Кортес, Э. (1999). «Стандартизированные составы рационов и трофические уровни акул». ICES J. Mar. Sci. 56 (5): 707–717. Дои:10.1006 / jmsc.1999.0489.
- ^ Pauly, D .; Trites, A .; Capuli, E .; Кристенсен, В. (1998). «Состав рациона и трофические уровни морских млекопитающих». ICES J. Mar. Sci. 55 (3): 467–481. Дои:10.1006 / jmsc.1997.0280.
- ^ Ученые впервые рассчитали трофический уровень человека Phys.org . 3 декабря 2013 г.
- ^ Bonhommeau, S., Dubroca, L., Le Pape, O., Barde, J., Kaplan, D.M., Chassot, E. и Nieblas, A.E. (2013) "Поедание мировой пищевой сети и трофического уровня человека". Труды Национальной академии наук, 110(51): 20617–20620. Дои:10.1073 / pnas.1305827110.
- ^ а б Хлорофилл Земная обсерватория НАСА. По состоянию на 30 ноября 2019 г.
- ^ Kettler GC, Martiny AC, Huang K, Zucker J, Coleman ML, Rodrigue S, Chen F, Lapidus A, Ferriera S, Johnson J, Steglich C, Church GM, Richardson P, Chisholm SW (декабрь 2007 г.). «Паттерны и последствия приобретения и потери генов в эволюции Prochlorococcus». PLOS Genetics. 3 (12): e231. Дои:10.1371 / journal.pgen.0030231. ЧВК 2151091. PMID 18159947.
- ^ Nemiroff, R .; Боннелл, Дж., Ред. (27 сентября 2006 г.). «Земля с Сатурна». Астрономическая картина дня. НАСА.
- ^ Партенский Ф., Гесс В. Р., Вауло Д. (март 1999 г.). «Прохлорококк, морской фотосинтетический прокариот мирового значения». Обзоры микробиологии и молекулярной биологии. 63 (1): 106–27. Дои:10.1128 / MMBR.63.1.106-127.1999. ЧВК 98958. PMID 10066832.
- ^ «Самый важный микроб, о котором вы никогда не слышали». npr.org.
- ^ Манн, Д. Г. (1999). «Видовая концепция диатомовых водорослей». Phycologia. 38 (6): 437–495. Дои:10.2216 / i0031-8884-38-6-437.1.
- ^ Биология копепод В архиве 2009-01-01 на Wayback Machine в Университет Карла фон Осецкого в Ольденбурге
- ^ а б c d Хейс, Г.К., Дойл, Т.К. и Хоутон, Дж. Д. (2018) "Смена парадигмы в трофической важности медуз?" Тенденции в экологии и эволюции, 33(11): 874-884. Дои:10.1016 / j.tree.2018.09.001
- ^ а б Гамильтон, Г. (2016) «Тайная жизнь медуз: долгое время считавшиеся второстепенными игроками в экологии океана, медузы на самом деле являются важными частями морской пищевой сети». Природа, 531(7595): 432-435. Дои:10.1038 / 531432a
- ^ Кардона, Л., Де Кеведо, И.А., Боррелл, А. и Агилар, А. (2012) "Массовое потребление студенистого планктона средиземноморскими хищниками вершины". PLOS ONE, 7(3): e31329. Дои:10.1371 / journal.pone.0031329
- ^ Крошечные кормовые рыбки на дне морской пищевой сети получают новую защиту Национальное общественное радио, 7 апреля 2016 г.
- ^ Роман, Дж. И Маккарти, Дж. Дж. (2010). «Китовый насос: морские млекопитающие повышают первичную продуктивность в прибрежном бассейне». PLOS ONE. 5 (10): e13255. Bibcode:2010PLoSO ... 513255R. Дои:10.1371 / journal.pone.0013255. ЧВК 2952594. PMID 20949007. e13255.CS1 maint: использует параметр авторов (связь)
- ^ Браун, Джошуа Э. (12 октября 2010 г.). «Китовые фекалии укрепляют океан». Science Daily. Получено 18 августа 2014.
- ^ Райна, J.B. (2018) "Жизнь в воде на микромасштабе". mSystems, 3(2): e00150-17. Дои:10.1128 / мСистемы.00150-17.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Марко, Д., изд. (2011). Метагеномика: современные инновации и будущие тенденции. Caister Academic Press. ISBN 978-1-904455-87-5.
- ^ а б c Рослин, Т. и Маянева, С. (2016) «Использование штрих-кодов ДНК в построении пищевой сети - объединение наземных и водных экологов!». Геном, 59(9): 603–628. Дои:10.1139 / gen-2015-0229.
- ^ Вильгельм, Стивен У .; Саттл, Кертис А. (1999). «Вирусы и круговорот питательных веществ в море». Бионаука. 49 (10): 781–788. Дои:10.2307/1313569. ISSN 1525-3244. JSTOR 1313569.
- ^ Вайнбауэр, Маркус Г. и др. «Синергетические и антагонистические эффекты вирусного лизиса и выпаса протистана на бактериальную биомассу, производство и разнообразие». Экологическая микробиология 9.3 (2007): 777-788.
- ^ Робинсон, Кэрол и Нагаппа Рамаях. «Скорость микробного гетеротрофного метаболизма ограничивает микробный углеродный насос». Американская ассоциация развития науки, 2011 г.
- ^ Van den Meersche, K., Middelburg, J.J., Soetaert, K., Van Rijswijk, P., Boschker, H.T. и Heip, C.H. (2004) «Связь углерода и азота и взаимодействия водорослей и бактерий во время экспериментального цветения: моделирование эксперимента с индикатором 13C». Лимнология и океанография, 49(3): 862–878. Дои:10.4319 / lo.2004.49.3.0862.
- ^ Käse L, Geuer JK. (2018) «Реакция фитопланктона на изменение морского климата - Введение». В Jungblut S., Liebich V., Bode M. (Eds) YOUMARES 8 - Мировой океан через границы: учимся друг у друга, страницы 55–72, Springer. Дои:10.1007/978-3-319-93284-2_5.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Heinrichs, M.E., Mori, C. и Dlugosch, L. (2020) «Сложные взаимодействия между водными организмами и их химической средой, выясненные с разных точек зрения». В: YOUMARES 9-Океаны: наши исследования, наше будущее , страницы 279–297. Springer. Дои:10.1007/978-3-030-20389-4_15.
- ^ Дюпончель, С., Фишер, М. (2019) «Да здравствуют лавидавирусы! Пять особенностей вирофагов, паразитирующих на гигантских ДНК-вирусах». PLoS патогены, 15(3). Дои:10.1371 / journal.ppat.1007592.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Фишер, М. Г .; Allen, M. J .; Wilson, W. H .; Саттл, К. А. (2010). «Гигантский вирус с замечательным набором генов заражает морской зоопланктон» (PDF). Труды Национальной академии наук. 107 (45): 19508–19513. Bibcode:2010PNAS..10719508F. Дои:10.1073 / pnas.1007615107. ЧВК 2984142. PMID 20974979.
- ^ Маттиас Г. Фишер; Майкл Дж. Аллен; Уильям Х. Уилсон; Кертис А. Саттл (2010). «Гигантский вирус с замечательным набором генов заражает морской зоопланктон» (PDF). Труды Национальной академии наук. 107 (45): 19508–19513. Bibcode:2010PNAS..10719508F. Дои:10.1073 / pnas.1007615107. ЧВК 2984142. PMID 20974979.
- ^ Массана, Рамон; Хавьер Дель Кампо; Кристиан Динтер; Рубен Соммаруга (2007). «Гибель популяции морских гетеротрофных жгутиконосцев. Кафетерий roenbergensis вирусной инфекцией ". Экологическая микробиология. 9 (11): 2660–2669. Дои:10.1111 / j.1462-2920.2007.01378.x. PMID 17922751. S2CID 30191542.
- ^ Фишер М.Г., Саттл, Калифорния (апрель 2011 г.). «Вирофаг в происхождении больших транспозонов ДНК». Наука. 332 (6026): 231–4. Bibcode:2011Наука ... 332..231F. Дои:10.1126 / science.1199412. PMID 21385722. S2CID 206530677.
- ^ Фишер М.Г., Хакл (декабрь 2016 г.). «Интеграция генома хозяина и гигантская вирус-индуцированная реактивация мавируса вирофага». Природа. 540 (7632): 288–91. Bibcode:2016Натура. 540..288F. Дои:10.1038 / природа20593. PMID 27929021. S2CID 4458402.
- ^ Кагами М., Мики Т. и Такимото Г. (2014) «Mycoloop: хитриды в водных пищевых сетях». Границы микробиологии, 5: 166. Дои:10.3389 / fmicb.2014.00166.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 3.0. - ^ Amend, A., Burgaud, G., Cunliffe, M., Edgcomb, VP, Ettinger, CL, Gutiérrez, MH, Heitman, J., Hom, EF, Ianiri, G., Jones, AC, и Kagami, M. ( 2019) «Грибы в морской среде: открытые вопросы и нерешенные проблемы». MBio, 10(2): e01189-18. Дои:10,1128 / мБио.01189-18.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Gutierrez MH, Jara AM, Pantoja S (2016) «Грибковые паразиты заражают морских диатомовых водорослей в апвеллинговой экосистеме системы течения Гумбольдта в центральной части Чили». Environ Microbiol, 18(5): 1646–1653. Дои:10.1111/1462-2920.13257.
- ^ а б c Мидделбург Дж. Дж. (2019) «Возвращение от органического углерода к неорганическому». В: Морская биогеохимия углерода: учебник для ученых-исследователей земных систем, страницы 37–56, Springer. Дои:10.1007/978-3-030-10822-9_3.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Legendre L, Rassoulzadegan F (1995) "Планктон и динамика питательных веществ в морских водах". Офелия, 41:153–172.
- ^ Пейс М.Л., Коул Дж. Дж., Карпентер С. Р., Китчелл Дж. Ф. (1999) «Трофические каскады, обнаруженные в различных экосистемах». Тенденции Ecol Evol, 14: 483–488.
- ^ Азам Ф., Фенчел Т., Филд Дж. Г., Грей Дж. С., Мейер-Рейл Л.А., Тингстад Ф. (1983) «Экологическая роль микробов водяного столба в море». Мар Экол-Прог Сер, 10: 257–263.
- ^ Anderson TR и LeB Williams PJ (1998) "Моделирование сезонного цикла растворенных органических карбонатов на станции E1 в проливе Ла-Манш". Estuar Coast Shelf Sci, 46: 93–109.
- ^ Ван ден Меерш К., Мидделбург Дж. Дж., Соетарт К., ван Рийсвейк П., Бошкер Х. Т.С., Хейп CHR (2004) «Связь углерода и азота и взаимодействия водорослей и бактерий во время экспериментального цветения: моделирование эксперимента с индикатором 13C». Лимнол Океаногр, 49: 862–878.
- ^ Suttle CA (2005) «Вирусы в море». Природа, 437: 356–361.
- ^ Сигел, Дэвид А .; Buesseler, Ken O .; Беренфельд, Майкл Дж .; Бенитес-Нельсон, Клаудиа Р .; Босс, Эммануэль; Бжезинский, Марк А .; Бурд, Адриан; Карлсон, Крейг А .; д'Азаро, Эрик А.; Дони, Скотт С .; Перри, Мэри Дж .; Стэнли, Рэйчел Х. Р.; Стейнберг, Дебора К. (2016). "Прогнозирование экспорта и судьбы чистой первичной продукции глобального океана: научный план EXPORTS". Границы морских наук. 3. Дои:10.3389 / fmars.2016.00022.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Ван, Ф., Ву, Ю., Чен, З., Чжан, Г., Чжан, Дж., Чжэн, С. и Каттнер, Г. (2019) «Трофические взаимодействия мезопелагических рыб в Южно-Китайском море, иллюстрированные стабильные изотопы и жирные кислоты ». Границы морских наук, 5: 522. Дои:10.3389 / fmars.2018.00522.
- ^ а б Толлефсон, Джефф (27 февраля 2020 г.) Войдите в сумеречную зону: ученые ныряют в загадочную середину океанов Новости природы. Дои:10.1038 / d41586-020-00520-8.
- ^ а б Чой, К.А., Хэддок, С.Х. и Робисон, Б. (2017) «Структура глубокой пелагической пищевой сети, выявленная на месте наблюдения за кормлением ». Труды Королевского общества B: биологические науки, 284(1868): 20172116. Дои:10.1098 / rspb.2017.2116.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Келли, Т.Б., Дэвисон, П.С., Герике, Р., Ландри, М.Р., Оман, М. и Стукель, М.Р. (2019) «Важность вертикальной миграции мезозоопланктона для поддержания мезопелагической пищевой сети». Границы морских наук, 6: 508. Дои:10.3389 / fmars.2019.00508.
- ^ В докладе говорится, что к середине века изменение климата в глубоких океанах может быть в семь раз быстрее Хранитель, 25 мая 2020.
- ^ Брито-Моралес, И., Шуман, Д.С., Молинос, Дж. Г., Берроуз, М.Т., Кляйн, С.Дж., Арафех-Далмау, Н., Кашнер, К., Гарилао, К., Кеснер-Рейес, К. и Ричардсон, А.Дж. (2020) «Скорость изменения климата показывает растущую подверженность глубоководного биоразнообразия океанам будущему потеплению». Природа Изменение климата, стр.1-6. Дои:10.5281 / zenodo.3596584.
- ^ Иригойен, X., Клевьер, Т.А., Рёстад, А., Мартинес, У., Бойра, Г., Акунья, Дж. Л., Боде, А., Эчеваррия, Ф., Гонсалес-Гордилло, Д. И., Эрнандес-Леон, С. и С. Агусти (2014) «Биомасса и трофическая эффективность крупных мезопелагических рыб в открытом океане». Связь с природой, 5: 3271. Дои:10.1038 / ncomms4271
- ^ Биомасса рыб в океане в 10 раз выше расчетной EurekAlert, 7 февраля 2014 г.
- ^ Чой, К.А., Вабниц, К.С., Вейерман, М., Вудворт-Джефкоутс, П.А. и Половина, Дж. Дж. (2016) «В поисках пути к вершине: как состав океанических среднетрофических групп микронектона определяет биомассу высших хищников в центральной части северной части Тихого океана». Серия "Прогресс морской экологии", 549: 9–25. Дои:10,3354 / meps11680.
- ^ а б c d е Курата, Н., Велла, К., Гамильтон, Б., Шивджи, М., Соловьев, А., Мэтт, С., Тартар, А. и Перри, В. (2016) «Бактерии, ассоциированные с поверхностно-активными веществами, в ближайшем будущем. -поверхностный слой океана ». Природа: Научные отчеты, 6(1): 1–8. Дои:10.1038 / srep19123.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Жутич В., Джосович Б., Марченко Э., Бихари Н. и Кршинич Ф. (1981) "Производство поверхностно-активных веществ морским фитопланктоном". Морская химия, 10(6): 505–520. Дои:10.1016/0304-4203(81)90004-9.
- ^ Левин Л.А., Бако А.Р., Боуден Д.А., Колако А, Кордес Э.Е., Кунха М.Р., Демопулос AWJ, Гобин Дж., Grupe BM, Ле Дж., Метаксас А, Нетбурн А.Н., Роуз Г.В., Тербер А.Р., Тунниклифф V, Ван Довер CL, Ванрезель А и Уотлинг Л. (2016). «Гидротермальные источники и выходы метана: переосмысление сферы влияния». Передний. Mar. Sci. 3:72. Дои:10.3389 / fmars.2016.00072
- ^ Портэйл, М., Олу, К., Дюбуа, С.Ф., Эскобар-Брионес, Э., Гелинас, Ю., Менот, Л. и Сарразин, Дж. (2016). «Сложность пищевой сети в гидротермальных жерлах и холодных выходах бассейна Гуаймас». PLOS ONE, 11(9): p.e0162263. Дои:10.1371 / journal.pone.0162263.
- ^ Бернардино А.Ф., Левин Л.А., Тербер А.Р. и Смит С.Р. (2012). «Сравнительный состав, разнообразие и трофическая экология макрофауны донных отложений на выходах, выходах и органических водопадах». PLOS ONE, 7 (4): e33515. pmid: 22496753. Дои:10.1371 / journal.pone.0033515.
- ^ Portail M, Olu K, Escobar-Briones E, Caprais JC, Menot L, Waeles M и др. (2015). «Сравнительное исследование сообществ жерловой и просачиваемой макрофауны в бассейне Гуаймас». Биогеонауки. 12 (18): 5455–79. Дои:10.5194 / bg-12-5455-2015.
- ^ а б Отеро, X.L., Де Ла Пенья-Ластра, С., Перес-Альберти, А., Феррейра, Т.О. и Huerta-Diaz, M.A. (2018) «Колонии морских птиц как важные глобальные движущие силы в круговоротах азота и фосфора». Связь с природой, 9(1): 1–8. Дои:10.1038 / s41467-017-02446-8. Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
- ^ Harris, P.T .; Macmillan-Lawler, M .; Rupp, J .; Бейкер, Э. (2014). «Геоморфология океанов». Морская геология. 352: 4–24. Дои:10.1016 / j.margeo.2014.01.011.
- ^ Хейманс, Дж. Дж., Колл, М., Либралато, С., Мориссетт, Л., Кристенсен, В. (2014). «Глобальные закономерности в экологических индикаторах морских пищевых сетей: подход к моделированию». PLOS ONE, 9(4). DOI: 10.1371 / journal.pone.0095845.
- ^ Пранови, Ф., Либралато, С., Райцевич, С., Гранзотто, А., Пастрес, Р., Джованарди, О. (2003). «Механические дноуглубительные работы в Венецианской лагуне: воздействие на экосистему оценивается с помощью трофической модели баланса массы». Морская биология, 143(2): 393–403. DOI: 10.1007 / s00227-003-1072-1.
- ^ Петерсен, Дж. К., Холмер, М., Термансен, М. и Хаслер, Б. (2019) "Извлечение питательных веществ двустворчатыми моллюсками". В: Smaal A., Ferreira J., Grant J., Petersen J., Strand Ø. (ред.) Товары и услуги морских двустворчатых моллюсков, страницы 179–208. Springer. Дои:10.1007/978-3-319-96776-9_10. ISBN 9783319967769
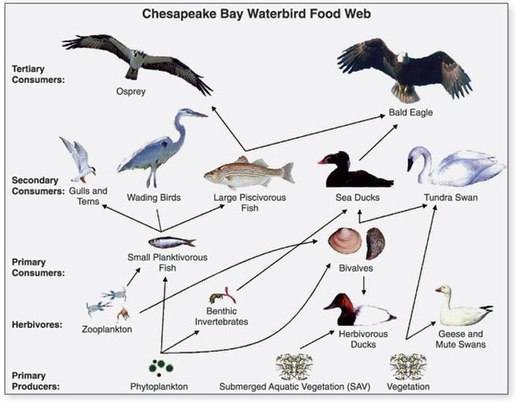
- ^ Геологическая служба США (USGS). «Глава 14: Изменения в еде и среде обитания водоплавающих птиц». Рисунок 14.1. Обобщение данных геологической службы США по экосистеме Чесапикского залива и их значение для управления окружающей средой. Циркуляр USGS 1316.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Перри, М.С., Осентон, П.К., Уэллс-Берлин, А.М., и Кидвелл, Д.М., 2005 г., Выбор корма среди морских уток Атлантического побережья в зависимости от исторических пищевых привычек, [абс.] В Перри, М.К., Вторая конференция по североамериканским морским уткам , 7–11 ноября 2005 г., Аннаполис, Мэриленд, Программа и тезисы, Исследовательский центр дикой природы USGS Patuxent, Мэриленд, 123 стр. (стр.105).
- ^ Баузер, А.К., Даймонд, А.В. и Аддисон, Дж. (2013) «От тупиков до планктона: анализ пищевой цепи морских птиц в северной части залива Мэн на основе ДНК». PLOS ONE, 8(12): e83152. Дои:10.1371 / journal.pone.0083152
- ^ Лере М, Мейер С.П., Миллс СК. (2015) «Метабарочный анализ рациона хищных рыб, обитающих в кораллах, демонстрирует незначительный вклад коралловых мутуалистов в их широко разделенный, универсальный рацион». PeerJ, 3: e1047. Дои:10.7717 / peerj.1047.
- ^ Стат, М., Хаггетт, М.Дж., Бернаскони, Р., ДиБаттиста, Д.Д., Берри, Т.Е., Ньюман, С.Дж., Харви, Э.С. и Банс, М. (2017) «Биомониторинг экосистемы с помощью eDNA: метабаркодирование по древу жизни в тропической морской среде». Научные отчеты, 7(1): 1–11. Дои:10.1038 / s41598-017-12501-5.
- ^ Лобо, Эдуардо А .; Генрих, Карла Гизельда; Щух, Марилия; Ветцель, Карлос Эдуардо; Эктор, Люк (2016), Некки-младший, Орландо (редактор), «Диатомовые водоросли как биоиндикаторы рек», Речные водоросли, Springer International Publishing, стр. 245–271, Дои:10.1007/978-3-319-31984-1_11, ISBN 9783319319834
- ^ Стивенсон, Р. Ян; Пан, Яндун; ван Дам, Герман (2010), Смол, Джон П .; Штёрмер, Юджин Ф. (ред.), "Оценка условий окружающей среды в реках и ручьях с диатомовыми водорослями", Диатомовые водоросли (2-е изд.), Cambridge University Press, стр. 57–85, Дои:10.1017 / cbo9780511763175.005, ISBN 9780511763175
- ^ Колл, М., Шмидт, А., Романюк, Т., Лотце, Х.К. (2011). «Пищевая сеть сообществ морских водорослей в различных пространственных масштабах и воздействия человека». PLOS ONE, 6(7): e22591. Дои:10.1371 / journal.pone.0022591.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Маккарти, Дж. Дж., Канциани, О. Ф., Лири, Н. А., Доккен, Д. Дж. и Уайт, К. (Ред.) (2001) Изменение климата 2001 г .: воздействия, адаптация и уязвимость: вклад Рабочей группы II в Третий оценочный доклад Межправительственной группы экспертов по изменению климата Стр. 807, Cambridge University Press. ISBN 9780521015004
- ^ Мерфи, Э.Дж., Кавана, Р.Д., Дринкуотер, К.Ф., Грант, С.М., Хейманс, Д.Дж., Хофманн, Э.Е., Хант-младший, Г.Л. и Джонстон, Н.М. (2016) «Понимание структуры и функционирования полярных пелагических экосистем для прогнозирования воздействия изменять". Труды Королевского общества B: биологические науки, 283(1844): 20161646. Дои:10.1098 / rspb.2016.1646.
- ^ Воздействие климата на экосистемы: разрушение пищевых сетей EPA. По состоянию на 11 февраля 2020 г.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «В Северном Ледовитом океане происходит« смена режима », - говорят ученые».. Phys.org. Получено 16 августа 2020.
- ^ Льюис, К. М .; Dijken, G. L. van; Арриго, К. Р. (10 июля 2020 г.). «Изменения в концентрации фитопланктона теперь приводят к увеличению первичной продукции в Северном Ледовитом океане». Наука. 369 (6500): 198–202. Дои:10.1126 / science.aay8380. ISSN 0036-8075. PMID 32647002. S2CID 220433818. Получено 16 августа 2020.
- ^ Стокер, Д. и Лаврентьев, П.Дж. (2018). «Миксотрофный планктон в полярных морях: панарктический обзор». Границы морских наук, 5: 292. Дои:10.3389 / fmars.2018.00292
- ^ Килиас, Эстель С .; Юнгес, Леандро; Шупраха, Лука; Леонард, Гай; Метфиес, Катя; Ричардс, Томас А. (2020). «Распространение хитридовых грибов и их совместное появление с диатомовыми водорослями коррелируют с таянием морского льда в Северном Ледовитом океане». Биология коммуникации. 3 (1): 183. Дои:10.1038 / с42003-020-0891-7. ЧВК 7174370. PMID 32317738. S2CID 216033140.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Бендер, С.Дж., Моран, Д.М., Макилвин, М.Р., Чжэн, Х., МакКроу, Дж. П., Баджер, Дж., Дитуллио, Г. Р., Аллен, А. Э. и Сайто, М. А. (2018) Phaeocystis antarctica: соединение молекулярных механизмов с биогеохимией железа ». Биогеонауки, 15(16): 4923–4942. Дои:10.5194 / bg-15-4923-2018.
- ^ Pinkernell, S. и Beszteri, B. (2014) «Потенциальные последствия изменения климата для ареала распространения основного силикатного грузила Южного океана». Экология и эволюция, 4(16): 3147–3161. Дои:10.1002 / ece3.1138
- ^ Каван, Э.Л., Белчер, А., Аткинсон, А., Хилл, С.Л., Кавагути, С., МакКормак, С., Мейер, Б., Никол, С., Ратнараджа, Л., Шмидт, К. и Стейнберг, DK (2019) «Значение антарктического криля в биогеохимических циклах». Связь с природой, 10(1): 1–13. Дои:10.1038 / s41467-019-12668-7.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б Кордоне, Г., Марина, Т.И., Салинас, В., Дойл, С.Р., Саравиа, Л.А., и Момо, Ф.Р. (2018). «Последствия утраты макроводорослей в морской пищевой сети Антарктики: применение пороговых значений вымирания к исследованиям пищевой сети». PeerJ, 6: e5531. Дои:10.7717 / peerj.5531
- ^ Марина, Т.И., Салинас, В., Кордоне, Г., Кампана, Г., Морейра, Э., Дерегибус, Д., Торре, Л., Сахаде, Р., Татиан, М., Оро, Э. и Де Трош, М. (2018). «Пищевая сеть Поттер-Коув (Антарктида): сложность, структура и функции». Estuarine, Coastal and Shelf Science, 200: 141–151. DOI: 10.1016 / j.ecss.2017.10.015.
- ^ Кох, Э.Й., Мартин, А.Р., Макминн, А., Райан, К.Г. (2012) «Последние достижения и перспективы в области микробной фототрофии во льдах Антарктики». Биология, 1(3): 542-556. Дои:10.3390 / biology1030542.
- ^ Микробная петля здесь перерисована и сокращена:
- Азам, Ф., Фенчел, Т., Филд, Дж. Г., Грей, Дж. С., Мейер-Рейл, Л. А. и Тингстад, Ф. (1983) «Экологическая роль микробов водяного столба в море». Серия "Прогресс морской экологии", 10(3): 257–263.
- Фенчел, Т. (2008) "Микробная петля - 25 лет спустя". Журнал экспериментальной морской биологии и экологии, 366(1-2): 99-103. Дои:10.1016 / j.jembe.2008.07.013.
- ^ Лами, Т., Кенигс, К., Холбрук, С.Дж., Миллер, Р.Дж., Стир, А.К. и Рид, Д.К. (2020) «Основные виды способствуют стабильности сообщества за счет увеличения разнообразия в гигантском лесу водорослей». Экология, e02987. Дои:10.1002 / ecy.2987.
- ^ Гигантские водоросли создают прочную основу для морских экосистем Южной Калифорнии, Национальный фонд науки, 4 февраля 2020 г.
- ^ Анджелини, Кристина; Altieri, Andrew H .; и другие. (Октябрь 2011 г.). «Взаимодействие между основными видами и их последствия для организации сообщества, биоразнообразия и сохранения». Бионаука. 61 (10): 782–789. Дои:10.1525 / bio.2011.61.10.8.
- ^ Эллисон, Аарон М .; Банк, Майкл С .; и другие. (Ноябрь 2005 г.). «Утрата основных видов: последствия для структуры и динамики лесных экосистем». Границы экологии и окружающей среды. 3 (9): 479–486. Дои:10.1890 / 1540-9295 (2005) 003 [0479: LOFSCF] 2.0.CO; 2.
- ^ Дейтон, П. К. 1972. На пути к пониманию устойчивости сообщества и потенциальных эффектов обогащения бентоса в проливе Мак-Мердо, Антарктида. С. 81–96 в материалах коллоквиума по проблемам сохранения, Аллен Пресс, Лоуренс, Канзас.
- ^ Пейн, Р. Т. (1995). «Беседа об уточнении концепции краеугольных пород». Биология сохранения. 9 (4): 962–964. Дои:10.1046 / j.1523-1739.1995.09040962.x.
- ^ Дэвик, Роберт Д. (2003). «Связывание видов краеугольных камней и функциональных групп: новое рабочее определение концепции видов краеугольных камней». Сохранение экологии. Получено 2011-02-03.
- ^ Пейн, Р. Т. (1969). «Заметка о трофической сложности и стабильности сообщества». Американский натуралист. 103 (929): 91–93. Дои:10.1086/282586. JSTOR 2459472. S2CID 83780992.
- ^ «Гипотеза краеугольного камня». Вашингтонский университет. Архивировано из оригинал на 2011-01-10. Получено 2011-02-03.
- ^ Пейн, Р. Т. (1966). «Сложность пищевой сети и видовое разнообразие». Американский натуралист. 100 (910): 65–75. Дои:10.1086/282400. JSTOR 2459379. S2CID 85265656.
- ^ Шпак, Пол; Орчард, Тревор Дж .; Salomon, Anne K .; Грёке, Даррен Р. (2013). «Региональная экологическая изменчивость и влияние морской торговли пушниной на прибрежные экосистемы в южной части Хайда-Гвайи (Британская Колумбия, Канада): данные анализа стабильных изотопов костного коллагена морского окуня (Sebastes spp.)». Археологические и антропологические науки. 5 (2): 159–182. Дои:10.1007 / s12520-013-0122-у. S2CID 84866250.
- ^ Кон, Дж. П. (1998). «Понимание морских выдр». Бионаука. 48 (3): 151–155. Дои:10.2307/1313259. JSTOR 1313259.
- ^ а б c Миллетт, Северная Каролина, Гроссе, Дж., Джонсон, В.М., Юнгблут, М.Дж., Сутер, Э.А. (2018). «Скрытые на виду: важность загадочных взаимодействий в морском планктоне». Письма по лимнологии и океанографии, 3(4): 341–356. Дои:10.1002 / lol2.10084.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
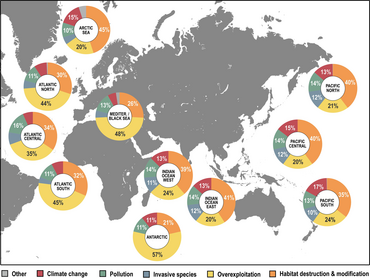
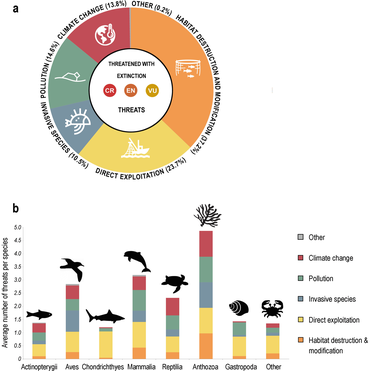
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б c Luypaert, T., Hagan, J.G., McCarthy, M.L. и М. Поти (2020) «Состояние морского биоразнообразия в антропоцене». В: YOUMARES 9-Океаны: наши исследования, наше будущее, страницы 57-82, Springer. Дои:10.1007/978-3-030-20389-4_4.
- ^ Эстес Дж. А., Тинкер М. Т., Уильямс Т. М. и др. (1998) «Хищничество косаток каланов, соединяющих океанические и прибрежные экосистемы». Наука, 282: 473–476. Дои:10.1126 / science.282.5388.473.
- ^ Пост, Д. М. (1993). «Длинная и короткая длина пищевой цепи». Тенденции в экологии и эволюции. 17 (6): 269–277. Дои:10.1016 / S0169-5347 (02) 02455-2.
- ^ Джерри Боброу, доктор философии; Стивен Фишер (2009). CliffsNotes CSET: несколько тем (2-е изд.). Джон Уайли и сыновья. п. 283. ISBN 978-0-470-45546-3.
- ^ Элтон С.С. (1927) Экология животных. Переиздано в 2001 году. University of Chicago Press.
- ^ Пейн RT (1966). «Сложность пищевой сети и видовое разнообразие». Американский натуралист. 100 (910): 65–75. Дои:10.1086/282400. S2CID 85265656.
- ^ а б Май РМ (2001) Стабильность и сложность модельных экосистем Princeton University Press, перепечатка издания 1973 года с новым предисловием. ISBN 978-0-691-08861-7.
- ^ а б Pimm SL (2002) Пищевые полотна University of Chicago Press, перепечатка издания 1982 года с новым предисловием. ISBN 978-0-226-66832-1.
- ^ Kotta, J .; Wernberg, T .; Jänes, H .; Kotta, I .; Нурксе, К .; Пярноя, М .; Орав-Котта, Х. (2018). «Новый хищник крабов вызывает изменение режима морской экосистемы». Научные отчеты. 8 (1): 4956. Дои:10.1038 / с41598-018-23282-в. ЧВК 5897427. PMID 29651152.
- ^ Мегри, Бернард и Вернер, Франциско. «Оценка роли регулирования экосистемы сверху вниз или снизу вверх с точки зрения моделирования» (PDF).CS1 maint: несколько имен: список авторов (связь)
- ^ Франк, К. Т .; Petrie, B .; Choi, J. S .; Леггетт, В. К. (2005). «Трофические каскады в экосистеме, в которой раньше преобладала треска». Наука. 308 (5728): 1621–1623. Дои:10.1126 / science.1113075. ISSN 0036-8075. PMID 15947186. S2CID 45088691.
- ^ Matsuzaki, Shin-Ichiro S .; Сузуки, Кента; Кадоя, Таку; Накагава, Мэгуми; Такамура, Норико (2018). «Восходящие связи между первичной продукцией, зоопланктоном и рыбой в мелководном гиперэвтрофном озере». Экология. 99 (9): 2025–2036. Дои:10.1002 / ecy.2414. PMID 29884987.
- ^ Линам, Кристофер Филип; Ллопе, Маркос; Мёлльманн, Кристиан; Helaouët, Пьер; Бейлисс-Браун, Джорджия Энн; Стенсет, Нильс К. (февраль 2017 г.). «Трофический и экологический контроль в Северном море». Труды Национальной академии наук. 114 (8): 1952–1957. Дои:10.1073 / pnas.1621037114. ЧВК 5338359. PMID 28167770.
- ^ "Старый список". Исследование колец деревьев Скалистых гор. Получено 8 января, 2013.
- ^ Ветцель, Роберт (2001). Лимнология: озерные и речные экосистемы. Сан-Диего: Academic Press. ISBN 9780127447605.
- ^ Бар-Он, Ю.М., Филлипс, Р. и Майло, Р. (2018) "Распределение биомассы на Земле". Труды Национальной академии наук, 115(25): 6506–6511. Дои:10.1073 / pnas.1711842115.
- ^ Спеллман, Фрэнк Р. (2008). Наука о воде: концепции и приложения. CRC Press. п. 167. ISBN 978-1-4200-5544-3.
- ^ Odum, E.P .; Барретт, Г. В. (2005). Основы экологии (5-е изд.). Брукс / Коул, часть Cengage Learning. ISBN 978-0-534-42066-6. Архивировано из оригинал на 2011-08-20.
- ^ Wang, H .; Моррисон, В .; Сингх, А .; Вайс, Х. (2009). «Моделирование перевернутых пирамид биомассы и убежищ в экосистемах» (PDF). Экологическое моделирование. 220 (11): 1376–1382. Дои:10.1016 / j.ecolmodel.2009.03.005. Архивировано из оригинал (PDF) на 2011-10-07.
- ^ Филд, К. Б., Беренфельд, М. Дж., Рандерсон, Дж. Т. и Фальковски П. (1998) «Первичное производство биосферы: интеграция наземных и океанических компонентов». Наука, 281(5374): 237–240. Дои:10.1126 / science.281.5374.237.
- ^ Мююро, А., Гаскуэль, Д., Коллетер, М., Паломарес, М.Л., Дю Понтавис, Х., Паули, Д. и Чунг, В.В. (2017) «Глобальные изменения в трофическом функционировании морских пищевых сетей». PLOS ONE, 12(8): e0182826. Дои:10.1371 / journal.pone.0182826
- ^ «Влияние закисления океана на морские виды и экосистемы». Отчет. ОКЕАНА. Получено 13 октября 2013.
- ^ «Комплексное изучение закисления Северного Ледовитого океана». Изучать. ЦИЦЕРОН. Архивировано из оригинал 10 декабря 2013 г.. Получено 14 ноября 2013.
- ^ Лищка, С .; Büdenbender J .; Boxhammer T .; Рибезелл У. (15 апреля 2011 г.). «Влияние закисления океана и повышенных температур на раннюю молодь полярного крылоногого крылоногого моллюска Limacina Helicina: смертность, разрушение и рост раковины» (PDF). Отчет. Биогеонауки. стр. 919–932. Получено 14 ноября 2013.
- ^ «Морская дикая природа Антарктики находится под угрозой, - говорится в исследовании». BBC Nature. Получено 13 октября 2013.
- ^ Уллах, Х., Нагелькеркен, И., Гольденберг, С.У. и Фордхэм, Д.А. (2018) «Изменение климата может привести к коллапсу морской трофической сети из-за изменения трофических потоков и распространения цианобактерий». PLoS биология, 16(1): e2003446. Дои:10.1371 / journal.pbio.2003446
- ^ а б Изменение климата вызывает коллапс морских пищевых сетей ScienceDaily. 9 января 2018.
- ^ МСОП (2018) Красный список видов, находящихся под угрозой исчезновения МСОП: Версия 2018-1