Глимфатическая система - Glymphatic system
| Глимфатическая система | |
|---|---|
Глимфатическая система млекопитающих | |
| Анатомическая терминология |
В глимфатическая система (или же глимфатический путь клиренса, или же параваскулярная система) является функционалом вывоз мусора путь для позвоночное животное Центральная нервная система (ЦНС).[1] Путь состоит из параартериального пути притока для спинномозговая жидкость (CSF) войти в мозг паренхима, соединенный с механизмом зазора для удаления тканевая жидкость (ISF) и внеклеточные растворенные вещества из межклеточных отсеков мозг и спинной мозг. Обмен растворенными веществами между CSF и ISF в основном обусловлен артериальная пульсация[2] и регулируется во время спать за счет расширения и сокращения внеклеточного пространства мозга. Удаление растворимых белки, продукты жизнедеятельности и избыток внеклеточной жидкости осуществляется за счет конвективной объемный поток ISF, чему способствует астроцитарный аквапорин 4 (AQP4) водные каналы.
Название «глимфатическая система» было придумано Датский нейробиолог Майкен Недергаард в знак признания своей зависимости от глиальные клетки и сходство его функций с периферийными лимфатическая система.[3]
Хотя изначально считалось, что глимфатический поток является полным ответом на давний вопрос о том, как чувствительная нервная ткань ЦНС функционирует при предполагаемом отсутствии лимфатического пути оттока внеклеточных белков, избыточной жидкости и продуктов метаболизма, два последующих статьи Louveau et al. от Медицинский факультет Университета Вирджинии и Aspelund et al. от Университет Хельсинки, независимо друг от друга сообщили об открытии, что на самом деле дуральные пазухи и менингеальный артерии выстланы обычным лимфатические сосуды, и что эта долго неуловимая сосудистая сеть образует соединительный путь к глимфатической системе.[4][5]
Предлагаемая структура

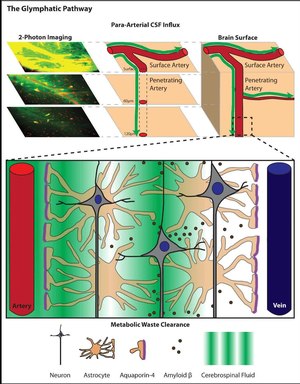
В исследовании, опубликованном в 2012 году,[6] группа исследователей из Университета Рочестера во главе с М. Недергаардом использовала in vivo двухфотонная визуализация малых флуоресцентных индикаторов для мониторинга потока субарахноидального спинномозговой жидкости в паренхиму мозга и через нее. Двухфотонная микроскопия позволила команде из Рочестера визуализировать поток спинномозговой жидкости у живых мышей в режиме реального времени без необходимости прокола отсека спинномозговой жидкости (визуализация выполнялась через закрытое черепное окно). Согласно результатам этого исследования, субарахноидальная спинномозговая жидкость быстро проникает в мозг через параваскулярные пространства, окружающие проникающие артерии, а затем обменивается с окружающей интерстициальной жидкостью.[6] Точно так же интерстициальная жидкость удаляется из паренхимы головного мозга через параваскулярные пространства, окружающие крупные дренажные вены.
Параваскулярные пространства представляют собой каналы, заполненные спинномозговой жидкостью, образованные между кровеносными сосудами головного мозга и лептоменингеальными оболочками, которые окружают сосуды поверхности мозга и проксимальные проникающие сосуды. Вокруг этих проникающих сосудов параваскулярные пространства принимают форму Пространства Вирхова-Робена. Там, где пространства Вирхова-Робина оканчиваются внутри паренхимы головного мозга, параваскулярная спинномозговая жидкость может продолжать перемещаться по базальным мембранам, окружающим гладкие мышцы артериальных сосудов, чтобы достичь базальной пластинки, окружающей капилляры головного мозга. Движение спинномозговой жидкости по этим параваскулярным путям происходит быстро, и артериальная пульсация долгое время считалась важной движущей силой для движения параваскулярной жидкости.[7] В исследовании, опубликованном в 2013 году, Дж. Илифф и коллеги продемонстрировали это напрямую. Используя 2-фотонную микроскопию in vivo, авторы сообщили, что когда церебральная артериальная пульсация либо увеличивалась, либо уменьшалась, скорость паравакулярного потока спинномозговой жидкости, в свою очередь, увеличивалась или уменьшалась соответственно.
Астроциты расширяют длинные отростки, которые взаимодействуют с нейронными синапсами, а также выступы, называемые «концевыми ножками», которые полностью покрывают оболочку всей сосудистой сети мозга. Хотя точный механизм полностью не изучен, известно, что астроциты способствуют изменению кровотока. [8][9] и долгое время считалось, что они играют роль в удалении отходов из мозга.[10] Исследователям давно известно, что астроциты экспрессируют водные каналы, называемые аквапорины.[11] Однако до недавнего времени не было идентифицировано физиологической функции, объясняющей их присутствие в астроцитах ЦНС млекопитающих. Аквапорины - это связанные с мембраной каналы, которые играют важную роль в регулировании потока воды в клетки и из них. По сравнению с простой диффузией присутствие аквапоринов в биологических мембранах способствует увеличению водопроницаемости в 3–10 раз.[12]В ЦНС экспрессируются два типа аквапоринов: аквапорин-1, который выражается специализированным эпителиальные клетки из сосудистое сплетение и аквапорин-4 (AQP4), который экспрессируется астроцитами.[13][14] Экспрессия аквапорина-4 в астроцитах сильно поляризована по отношению к отросткам концевого отдела стопы, окружающим сосудистую сеть головного мозга. До 50% обращенной к сосуду поверхности торца стопы, которая обращена к сосудистой сети, занято ортогональными массивами AQP4.[11][13]В 2012 было показано, что AQP4 необходим для параваскулярного обмена CSF – ISF. Анализ генетически модифицированных мышей, у которых отсутствовал ген AQP4, показал, что зависимый от объемного потока клиренс интерстициальных растворенных веществ снижается на 70% в отсутствие AQP4. Основываясь на этой роли AQP4-зависимого транспорта глиальной воды в процессе параваскулярного интерстициального клиренса растворенных веществ, Илифф и Недергаард назвали этот глио-сосудистый путь, охватывающий весь мозг, «глимфатической системой».
Функция
Удаление отходов во время сна
Публикация Л. Се и его коллег в 2013 году исследовала эффективность глимфатической системы во время медленных волн. спать и предоставили первое прямое доказательство того, что удаление промежуточных отходов увеличивается в состоянии покоя. Использование комбинации диффузии ионтофорез методы, впервые примененные Николсоном и его коллегами, двухфотонная визуализация in vivo и электроэнцефалография Для подтверждения состояний бодрствования и сна Ся и Недергаард продемонстрировали, что изменения в эффективности обмена CSF-ISF между бодрствующим и спящим мозгом были вызваны расширением и сокращением внеклеточного пространства, которое увеличивалось на ~ 60% в спящем мозгу до способствовать удалению интерстициальных отходов, таких как бета-амилоид.[15] На основе этих результатов они выдвинули гипотезу, что восстановительные свойства сна могут быть связаны с повышенным глимфатическим клиренсом метаболических отходов, производимых нервной активностью в бодрствующем мозге.
Липидный транспорт
Еще одна ключевая функция глимфатической системы была задокументирована Трейном и др., Которые в 2013 году продемонстрировали, что система параваскулярных путей мозга играет важную роль в транспортировке небольших липофильных молекул.[16] Под руководством М. Недергаарда, Трейн и его коллеги также показали, что параваскулярный транспорт липидов по глимфатическому пути активирует передачу сигналов глиального кальция и что снижение давления в полости черепа и, таким образом, нарушение глимфатического кровообращения приводит к неселективной диффузии липидов, внутриклеточных липидов накопление и патологическая сигнализация среди астроцитов. Хотя необходимы дальнейшие эксперименты, чтобы проанализировать физиологическое значение связи между глимфатической циркуляцией, передачей сигналов кальция и параваскулярным транспортом липидов в головном мозге, результаты указывают на принятие функции ЦНС, аналогичной способности кишечной лимфы. сосуды (молочные железы ) переносить липиды в печень.
Клиническое значение
Патологически, нейродегенеративные заболевания Такие как боковой амиотрофический склероз, Болезнь Альцгеймера, болезнь Паркинсона, и болезнь Хантингтона все они характеризуются прогрессирующей потерей нейронов, снижением когнитивных функций, двигательными нарушениями и потерей чувствительности.[17][18] В совокупности эти болезни попадают в широкую категорию, называемую протеинопатии из-за общей сборки неправильно свернутых или агрегированных внутриклеточных или внеклеточных белков. Согласно преобладающим амилоид гипотеза болезни Альцгеймера, скопление амилоид-бета (пептид, который обычно вырабатывается и выводится из здорового молодого мозга) во внеклеточные бляшки, вызывает потерю нейронов и атрофию мозга, что является признаком деменции Альцгеймера. Хотя полная степень участия глимфатической системы в болезни Альцгеймера и других нейродегенеративных заболеваниях остается неясной, исследователи продемонстрировали в экспериментах с генетически модифицированными мышами, что правильная функция глимфатической системы клиренса была необходима для удаления растворимого бета-амилоида из мозга. интерстиций.[6] У мышей, у которых отсутствует ген AQP4, клиренс бета-амилоида снижается примерно на 55 процентов.
Глимфатическая система также может быть нарушена после острых травм головного мозга, таких как ишемический приступ, внутричерепное кровоизлияние, или же субарахноидальное кровоизлияние. В 2014 году группа исследователей из Французского института здоровья и медицинских исследований (INSERM ) продемонстрировано МРТ что лимфатическая система была нарушена после субарахноидального кровоизлияния из-за наличия свернувшейся крови в параваскулярных пространствах.[19] Инъекция тканевый активатор плазминогена (фибринолитический препарат) в спинномозговой жидкости улучшает работу лимфатической системы. В параллельном исследовании они также продемонстрировали, что глимфатическая система была нарушена после ишемический приступ в ишемическом полушарии, хотя патофизиологическая основа этого явления остается неясной. Примечательно, что реканализация закупоренной артерии также восстановила глимфатический кровоток.
Глимфатическая система также может участвовать в патогенез из боковой амиотрофический склероз.[20]
История
Описание спинномозговой жидкости
Хотя первые известные наблюдения CSF относятся к Гиппократ (460–375 гг. До н.э.) и позже, Гален (130–200 г. н.э.), его открытие приписывают Эмануэль Сведенборг (1688–1772 гг. Н. Э.), Который, будучи искренне религиозным человеком, идентифицировал CSF во время своих поисков обители души.[21] Анатомы 16-го века, пришедшие после Гиппократа и Галена, возможно, упустили возможность идентифицировать спинномозговую жидкость из-за преобладающей в то время техники вскрытия, которая включала отрубание головы и слив крови перед рассечением мозга.[21] Хотя работа Сведенборга (в переводе) не была опубликована до 1887 года из-за отсутствия у него медицинских данных, он также, возможно, впервые установил связь между ЦСЖ и лимфатической системой. Его описание спинномозговой жидкости было «одухотворенной лимфой».[21]
Лимфатические сосуды ЦНС
В периферических органах лимфатическая система выполняет важные иммунные функции и работает параллельно система кровообращения для обеспечения вторичного обращения, транспортирующего излишки тканевая жидкость, белки, и продукты метаболизма из системных тканей обратно в кровь. Эффективное удаление растворимых белков из межклеточной жидкости имеет решающее значение для регуляции обоих коллоидный осмотическое давление и гомеостатическая регуляция жидкого объема тела. Важность лимфатического потока особенно очевидна, когда лимфатическая система становится заблокированной. При лимфатических заболеваниях, таких как слоновость (где паразиты, занимающие лимфатические сосуды, блокируют отток лимфа ), воздействие такого препятствия может быть драматичным. В результате хронический отек происходит из-за нарушения лимфатического клиренса и накопления растворенных веществ в межклеточном пространстве.
В 2015 г. наличие менингеальная лимфатическая система был впервые идентифицирован.[4][5] Ниже по ходу отведения отходов глимфатической системы от ISF к CSF менингеальная лимфатическая система отводит жидкость из глимфатической системы в менингеальный отсек и глубокие шейные лимфатические узлы. Менингеальные лимфатические сосуды также несут иммунные клетки. Степень, в которой эти клетки могут напрямую взаимодействовать с мозгом или глимфатической системой, неизвестна.
Гипотеза диффузии
Более века преобладала гипотеза о том, что поток спинномозговая жидкость (CSF), который окружает, но не вступает в прямой контакт с паренхима ЦНС, может замещать периферические лимфатические функции и играть важную роль в клиренсе внеклеточных растворенных веществ.[22]Большинство CSF формируется в сосудистое сплетение и проходит через мозг определенным путем: двигаясь через церебрально-желудочковая система, в субарахноидальное пространство окружает мозг, а затем попадает в системный столб крови через арахноидальные грануляции из дуральные пазухи или в периферические лимфатические сосуды вдоль оболочки черепных нервов.[23][24] Многие исследователи предположили, что отсек спинномозговой жидкости представляет собой сток для межклеточных растворенных веществ и выведения жидкости из паренхимы мозга.[нужна цитата ] Однако расстояния между интерстициальной жидкостью и ликвором в желудочках и субарахноидальном пространстве слишком велики для эффективного удаления интерстициальной жидкости. макромолекулы и отходы простая диффузия один.[нужна цитата ] Хелен Серр из Университета Брауна подсчитала, что среднее время диффузии для больших молекул, таких как альбумин, превысит 100 часов, чтобы пересечь 1 см ткани мозга,[25] скорость, несовместимая с интенсивные метаболические потребности мозговой ткани. Кроме того, система очистки, основанная на простой диффузии, не будет обладать чувствительностью, чтобы быстро реагировать на отклонения от гомеостатических условий.
Ключевыми детерминантами диффузии через интерстициальные пространства мозга являются размеры и состав внеклеточного компартмента. В серии элегантно разработанных экспериментов в 1980-х и 1990-х годах К. Николсон и его коллеги из Нью-Йоркского университета исследовали микросреду внеклеточного пространства, используя ионоселективные микропипетки и точечные ионофоретические источники. Используя эти методы, Николсон показал, что движение растворенных веществ и воды через паренхиму мозга замедляется по мере того, как фракция внеклеточного объема уменьшается и становится более извилистой.[26]
В качестве альтернативного объяснения диффузии Ксерр и его коллеги предложили: конвективный объемный поток Интерстициальная жидкость из паренхимы головного мозга в спинномозговую жидкость была ответственна за эффективное удаление отходов.[25]
Прогресс в области динамики спинномозговой жидкости
Эксперименты, проведенные в Университете Мэриленда в 1980-х Патрисией Грэди и его коллегами, постулировали существование обмена растворенными веществами между интерстициальной жидкостью паренхимы головного мозга и спинномозговой жидкостью через параваскулярные пространства. В 1985 году Грэди и его коллеги предположили, что спинномозговая жидкость и интерстициальная жидкость обмениваются по определенным анатомическим путям в головном мозге, при этом спинномозговая жидкость перемещается в мозг по внешней стороне кровеносных сосудов. Группа Грэди предположила, что эти «параваскулярные каналы» были функционально аналогичны периферическим лимфатическим сосудам, облегчая удаление интерстициальных отходов из мозга.[7][27] Однако другие лаборатории в то время не наблюдали такого широко распространенного параваскулярного обмена CSF-ISF.[25][28][29][30]
Непрерывность между интерстициальной жидкостью мозга и спинномозговой жидкостью была подтверждена Х. Серром и его коллегами из Университета Брауна и Королевского колледжа Лондона.[30] Эта же группа постулировала, что интерстициальные растворенные вещества в паренхиме мозга обмениваются с спинномозговой жидкостью через механизм объемного потока, а не диффузию. Однако другая работа из той же лаборатории показала, что обмен спинномозговой жидкости с интерстициальной жидкостью был непоследовательным и незначительным, что противоречит выводам Грэди и его коллег.[28][29]
Рекомендации
- ^ Бацынски А., Сюй М., Ван В., Ху Дж. (2017). «Параваскулярный путь удаления мозговых отходов: текущее понимание, значение и противоречия». Границы нейроанатомии. 11: 101. Дои:10.3389 / fnana.2017.00101. ЧВК 5681909. PMID 29163074.
- ^ Кивиниеми В., Ван Х, Корхонен В., Кейнянен Т., Туовинен Т., Аутио Дж. И др. (Июнь 2016). "Сверхбыстрая магнитно-резонансная энцефалография физиологической активности мозга - механизмы глимфатической пульсации?". Журнал церебрального кровотока и метаболизма. 36 (6): 1033–45. Дои:10.1177 / 0271678X15622047. ЧВК 4908626. PMID 26690495.
- ^ Конникова М. (11 января 2014 г.). "Спокойной ночи. Сон чистый". Нью-Йорк Таймс. Получено 18 февраля 2014.
Она назвала это глимфатической системой, в знак ее зависимости от глиальных клеток.
- ^ а б Louveau A, Smirnov I., Keyes TJ, Eccles JD, Rouhani SJ, Peske JD, et al. (Июль 2015 г.). «Структурно-функциональные особенности лимфатических сосудов центральной нервной системы». Природа. 523 (7560): 337–41. Bibcode:2015Натура.523..337L. Дои:10.1038 / природа14432. ЧВК 4506234. PMID 26030524.
- ^ а б Аспелунд А., Антила С., Пру С.Т., Карлсен Т.В., Караман С., Детмар М. и др. (Июнь 2015 г.). «Дуральная лимфатическая сосудистая система, отводящая межклеточную жидкость мозга и макромолекулы». Журнал экспериментальной медицины. 212 (7): 991–9. Дои:10.1084 / jem.20142290. ЧВК 4493418. PMID 26077718.
- ^ а б c Илифф Дж. Дж., Ван М., Ляо Ю., Плогг Б. А., Пэн В., Гундерсен Г. А. и др. (Август 2012 г.). «Параваскулярный путь способствует прохождению спинномозговой жидкости через паренхиму головного мозга и очищению интерстициальных растворенных веществ, включая амилоид β». Научная трансляционная медицина. 4 (147): 147ra111. Дои:10.1126 / scitranslmed.3003748. ЧВК 3551275. PMID 22896675.
- ^ а б Реннелс М.Л., Грегори Т.Ф., Блауманис О.Р., Фудзимото К., Грейди П.А. (февраль 1985 г.). «Доказательства« параваскулярной »циркуляции жидкости в центральной нервной системе млекопитающих, обеспеченные быстрым распределением индикаторного белка по всему мозгу из субарахноидального пространства». Исследование мозга. 326 (1): 47–63. Дои:10.1016/0006-8993(85)91383-6. PMID 3971148. S2CID 23583877.
- ^ Такано Т., Тиан Г.Ф., Пэн В., Лу Н., Либионка В., Хан Х, Недергаард М. (февраль 2006 г.). «Астроцит-опосредованный контроль мозгового кровотока». Природа Неврология. 9 (2): 260–7. Дои:10.1038 / nn1623. PMID 16388306. S2CID 6140428.
- ^ Шуммерс Дж., Ю. Х., Сур М. (июнь 2008 г.). «Настроенные ответы астроцитов и их влияние на гемодинамические сигналы в зрительной коре». Наука. 320 (5883): 1638–43. Bibcode:2008Sci ... 320.1638S. Дои:10.1126 / science.1156120. PMID 18566287. S2CID 16895889.
- ^ Юхас Д. (2012). «Как мозг очищает себя». Природа. Дои:10.1038 / природа.2012.11216. ISSN 1476-4687. S2CID 183462941.
- ^ а б Амири-Могхаддам М., Оттерсен О.П. (декабрь 2003 г.). «Молекулярные основы водного транспорта в головном мозге». Обзоры природы. Неврология. 4 (12): 991–1001. Дои:10.1038 / номер 1252. PMID 14682361. S2CID 23975497.
- ^ Веркман А.С., Митра А.К. (январь 2000 г.). «Строение и функция водных каналов аквапоринов». Американский журнал физиологии. Почечная физиология. 278 (1): F13-28. Дои:10.1152 / айпренал.2000.278.1.F13. PMID 10644652.
- ^ а б Веркман А.С., Биндер Д.К., Блох О., Огюст К., Пападопулос М.С. (август 2006 г.). «Три различные роли аквапорина-4 в функции мозга, выявленные нокаут-мышами». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1758 (8): 1085–93. Дои:10.1016 / j.bbamem.2006.02.018. PMID 16564496.
- ^ Yool AJ (октябрь 2007 г.). «Аквапорины: множество ролей в центральной нервной системе». Нейробиолог. 13 (5): 470–85. Дои:10.1177/1073858407303081. PMID 17901256. S2CID 46231509.
- ^ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, et al. (Октябрь 2013). «Сон стимулирует выведение метаболитов из мозга взрослого человека». Наука. 342 (6156): 373–7. Bibcode:2013Наука ... 342..373X. Дои:10.1126 / science.1241224. ЧВК 3880190. PMID 24136970.
- ^ Рангу Трейн V, Трейн А.С., Плог Б.А., Тиягараджан М., Илифф Дж. Дж., Дин Р. и др. (2013). «Параваскулярная микроциркуляция способствует быстрому транспорту липидов и передаче сигналов астроцитами в мозг». Научные отчеты. 3: 2582. Bibcode:2013НатСР ... 3Э2582Т. Дои:10.1038 / srep02582. ЧВК 3761080. PMID 24002448.
- ^ Мехлер М.Ф., Гохан С. (декабрь 2000 г.). «Механизмы, лежащие в основе гибели нервных клеток при нейродегенеративных заболеваниях: изменения клеточного реостата, опосредованного развитием». Тенденции в неврологии. 23 (12): 599–605. Дои:10.1016 / s0166-2236 (00) 01705-7. PMID 11137149. S2CID 21302044.
- ^ Нарасимхан К. (март 2006 г.). «Количественная оценка потери двигательных нейронов при БАС». Природа Неврология. 9 (3): 304. Дои:10.1038 / nn0306-304. PMID 16498424. S2CID 1933099.
- ^ Габерел Т., Гакуба С., Гулай Р., Мартинес Де Лисаррондо С., Хануз Дж. Л., Эмери Эмери и др. (Октябрь 2014 г.). «Нарушение перфузии лимфатической системы после инсультов, выявленное с помощью МРТ с контрастным усилением: новая мишень для фибринолиза?». Гладить. 45 (10): 3092–6. Дои:10.1161 / STROKEAHA.114.006617. PMID 25190438.[постоянная мертвая ссылка ]
- ^ Ng Kee Kwong KC, Mehta AR, Nedergaard M, Chandran S (август 2020 г.). «Определение новых функций спинномозговой жидкости в патофизиологии БАС». Рассмотрение. Acta Neuropathologica Communications. 8 (1): 140. Дои:10.1186 / s40478-020-01018-0. ЧВК 7439665. PMID 32819425.
- ^ а б c Хайду С (2003). «Записка из истории: открытие спинномозговой жидкости» (PDF). Анналы клинической и лабораторной науки. 33 (3).
- ^ Abbott NJ, Pizzo ME, Preston JE, Janigro D, Thorne RG (март 2018 г.). «Роль мозговых барьеров в движении жидкости в ЦНС: существует ли« глимфатическая »система?». Acta Neuropathologica. 135 (3): 387–407. Дои:10.1007 / s00401-018-1812-4. PMID 29428972.
- ^ Эбботт, штат Нью-Джерси (сентябрь 2004 г.). «Доказательства объемного потока межклеточной жидкости головного мозга: значение для физиологии и патологии». Neurochemistry International. 45 (4): 545–52. Дои:10.1016 / j.neuint.2003.11.006. PMID 15186921. S2CID 10441695.
- ^ Bradbury MW, Cserr HF, Westrop RJ (апрель 1981 г.). «Дренирование церебральной интерстициальной жидкости в глубокую шейную лимфу кролика». Американский журнал физиологии. 240 (4): F329-36. Дои:10.1152 / ajprenal.1981.240.4.F329. PMID 7223890.
- ^ а б c Cserr HF (апрель 1971 г.). «Физиология сосудистого сплетения». Физиологические обзоры. 51 (2): 273–311. Дои:10.1152 / Physrev.1971.51.2.273. PMID 4930496.
- ^ Николсон С., Филлипс Дж. М. (декабрь 1981 г.). «Диффузия ионов, измененная извилистостью и объемной долей во внеклеточном микроокружении мозжечка крысы». Журнал физиологии. 321: 225–57. Дои:10.1113 / jphysiol.1981.sp013981. ЧВК 1249623. PMID 7338810.
- ^ Реннельс М.Л., Блауманис О.Р., Грейди П.А. (1990). «Быстрый транспорт растворенных веществ по всему мозгу через параваскулярные пути жидкости». Достижения в неврологии. 52: 431–9. PMID 2396537.
- ^ а б Pullen RG, DePasquale M, Cserr HF (сентябрь 1987 г.). «Объемный поток спинномозговой жидкости в мозг в ответ на острую гиперосмоляльность». Американский журнал физиологии. 253 (3 ч. 2): F538-45. Дои:10.1152 / ajprenal.1987.253.3.F538. PMID 3115117.
- ^ а б Ichimura T, Fraser PA, Cserr HF (апрель 1991 г.). «Распределение внеклеточных индикаторов в периваскулярных пространствах головного мозга крысы». Исследование мозга. 545 (1–2): 103–13. Дои:10.1016/0006-8993(91)91275-6. PMID 1713524. S2CID 41924137.
- ^ а б Cserr HF, Cooper DN, Suri PK, Patlak CS (апрель 1981 г.). «Вытекание радиоактивно меченных полиэтиленгликолей и альбумина из мозга крысы». Американский журнал физиологии. 240 (4): F319-28. Дои:10.1152 / ajprenal.1981.240.4.F319. PMID 7223889.
дальнейшее чтение
- Конникова М (11.01.2014). "Спокойной ночи. Сон чистый". Нью-Йорк Таймс. Получено 2014-01-20.
- Шоу Джи (10.07.2015). «Новое исследование предполагает, что мозг связан с лимфатической системой: что это открытие может означать для неврологии». AAN. Получено 2015-07-10.
- Джессен Н.А., Мунк А.С., Лундгаард И., Недергаард М. (декабрь 2015 г.). «Глимфатическая система: руководство для новичков». Нейрохимические исследования. 40 (12): 2583–99. Дои:10.1007 / s11064-015-1581-6. ЧВК 4636982. PMID 25947369.