Митохондриальная ДНК - Mitochondrial DNA
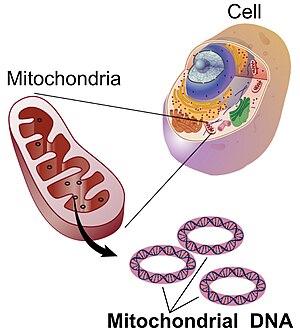
Митохондриальная ДНК (мтДНК или мДНК)[3] это ДНК находится в митохондрии, Сотовая связь органеллы в пределах эукариотический клетки, которые преобразуют химическую энергию из пищи в форму, которую клетки могут использовать, аденозинтрифосфат (АТФ). Митохондриальная ДНК - это лишь небольшая часть ДНК в эукариотической клетке; большую часть ДНК можно найти в ядро клетки а также в растениях и водорослях пластиды такие как хлоропласты.
Митохондриальная ДНК человека была первой значительной частью человеческий геном быть упорядоченным.[4] Это секвенирование показало, что мтДНК человека включает 16 569 пар оснований и кодирует 13 белки.
Поскольку мтДНК животных развивается быстрее ядерных генетических маркеров,[5][6][7] он представляет собой основу филогенетика и эволюционная биология. Это также позволяет исследовать родство популяций, что стало важным в антропология и биогеография.
Происхождение
Считается, что ядерная и митохондриальная ДНК являются отдельными эволюционный происхождения, причем мтДНК происходит из кольцевых геномов бактерии которые были поглощены ранними предками сегодняшних эукариотических клеток. Эта теория называется эндосимбиотическая теория. В клетках современных организмов подавляющее большинство белков, присутствующих в митохондриях (насчитывает около 1500 различных типов в млекопитающие ) кодируются ядерная ДНК, но считается, что гены некоторых, если не большинства, из них изначально имели бактериальное происхождение, а затем были перенесены в эукариотический ядро во время эволюция.[8]
Причины, по которым митохондрии сохранили некоторые гены, обсуждаются. Наличие у некоторых видов митохондриальных органелл, лишенных генома.[9] предполагает, что возможна полная потеря гена, а перенос митохондриальных генов в ядро имеет несколько преимуществ.[10] Сложность доставки удаленно продуцируемых гидрофобных белковых продуктов в митохондрии является одной из гипотез, почему некоторые гены сохраняются в мтДНК;[11] колокализация для редокс-регуляции другой, ссылающийся на желательность локального контроля над митохондриальными механизмами.[12] Недавний анализ широкого спектра геномов мтДНК предполагает, что обе эти особенности могут определять сохранение митохондриальных генов.[8]
Структура и разнообразие генома
У всех организмов существует шесть основных типов геномов, обнаруженных в митохондриальных геномах, которые классифицируются по их структуре (например, круговая или линейная), размеру, наличию интроны или плазмидоподобные структуры, и является ли генетический материал отдельной молекулой или совокупностью однородный или неоднородный молекулы.[13]
У многих одноклеточных организмов (например, инфузория Тетрахимена и зеленая водоросль Chlamydomonas reinhardtii ), а также в редких случаях у многоклеточных организмов (например, у некоторых видов Книдария ), мтДНК обнаруживается как линейно организованная ДНК. Большинство этих линейных мтДНК обладают теломераза -независимый теломеры (т.е. концы линейного ДНК ) с различными способами репликации, что сделало их интересными объектами исследования, поскольку многие из этих одноклеточных организмов с линейной мтДНК известны патогены.[14]
Животные
У большинства животных, особенно у двустворчатых, митохондриальный геном кольцевой формы. Medusozoa и Calcarea однако у клад есть виды с линейными митохондриальными хромосомами. [15]
С точки зрения пар оснований, анемон Isarachnanthus nocturnus имеет самый большой митохондриальный геном среди всех животных - 80 923 п.н.[16]
В феврале 2020 года паразит, связанный с медузами - Henneguya salminicola - было обнаружено, что в нем отсутствует митохондриальный геном, но сохраняются структуры, которые считаются связанными с митохондриями органеллами. Более того, гены ядерной ДНК, участвующие в аэробном дыхании, репликации и транскрипции митохондриальной ДНК, либо отсутствуют, либо присутствуют только в виде псевдогенов. Это первый многоклеточный организм, у которого отсутствует аэробное дыхание и который живет полностью без кислородной зависимости.[17][18]
Растения и грибы
Есть три разных типа митохондриальных геномов растений и грибов. Первый тип - это кольцевой геном, который имеет интроны (тип 2) и может иметь длину от 19 до 1000 т.п.н. Второй тип генома представляет собой кольцевой геном (около 20–1000 т.п.н.), который также имеет плазмидоподобную структуру (1 т.п.н.) (тип 3). Последний тип генома, который можно найти у растений и грибов, - это линейный геном, состоящий из гомогенных молекул ДНК (тип 5).
Среди грибов и растений существуют большие различия в содержании и размере генов мтДНК, хотя, по-видимому, существует основная подгруппа генов, которые присутствуют во всех эукариотах (за исключением нескольких, у которых митохондрии вообще отсутствуют).[8]Некоторые виды растений имеют огромные митохондриальные геномы с Silene conica мтДНК, содержащая до 11 300 000 пар оснований.[19] Удивительно, но даже эти огромные мтДНК содержат такое же количество и виды генов, что и родственные растения с гораздо меньшими мтДНК.[20]Геном митохондрии огурца (Cucumis sativus ) состоит из трех круговых хромосом (длиной 1556, 84 и 45 тысяч пар оснований), которые полностью или в значительной степени автономны в отношении своих репликация.[21]
Протисты
Протисты содержат самые разнообразные митохондриальные геномы, пять различных типов встречаются в этом царстве. Тип 2, тип 3 и тип 5, упомянутые в геномах растений и грибов, также существуют у некоторых протистов, как и два уникальных типа генома. Один из этих уникальных типов представляет собой гетерогенный набор кольцевых молекул ДНК (тип 4), а другой - гетерогенный набор линейных молекул (тип 6). Типы генома 4 и 6 имеют размер от 1 до 200 т.п.н.
Наименьший из секвенированных на сегодняшний день митохондриальных геномов - это мтДНК паразита размером 5967 п.н. Плазмодий falciparum.[22][23]
Перенос эндосимбиотических генов, процесс, с помощью которого гены, закодированные в митохондриальном геноме, переносятся в основной геном клетки, вероятно, объясняет, почему более сложные организмы, такие как люди, имеют меньшие митохондриальные геномы, чем более простые организмы, такие как протисты.
| Тип генома[13] | Королевство | Интроны | Размер | Форма | Описание |
|---|---|---|---|---|---|
| 1 | Животное | Нет | 11–28 кбит | Круговой | Одиночная молекула |
| 2 | Грибы, Завод, Протиста | да | 19–1000 кбит / с | Круговой | Одиночная молекула |
| 3 | Грибы, Завод, Протиста | Нет | 20–1000 кбит / с | Круговой | Большие молекулы и небольшие плазмидоподобные структуры |
| 4 | Протиста | Нет | 1–200 кбит / с | Круговой | Гетерогенная группа молекул |
| 5 | Грибы, Завод, Протиста | Нет | 1–200 кбит / с | Линейный | Однородная группа молекул |
| 6 | Протиста | Нет | 1–200 кбит / с | Линейный | Гетерогенная группа молекул |
Репликация
Митохондриальная ДНК реплицируется ДНК-полимераза гамма-комплекс, который состоит из каталитической ДНК-полимеразы 140 кДа, кодируемой ПОЛЬГ ген и две дополнительные субъединицы массой 55 кДа, кодируемые POLG2 ген.[24] Реплисомный аппарат формируется ДНК-полимеразой, Мерцать и митохондриальные SSB белки. Мерцать это геликаза, который разматывает короткие участки дцДНК в направлении от 5 'до 3'.[25] Все эти полипептиды кодируются в ядерном геноме.
В течение эмбриогенез, репликация мтДНК строго подавляется из оплодотворенного ооцита через преимплантационный эмбрион.[26] Результирующее снижение количества копий мтДНК на клетку играет роль в митохондриальном узком месте, используя изменчивость от клетки к клетке улучшить наследственность повреждающих мутаций.[27] По словам Джастина Сент-Джона и его коллег, "В бластоциста стадии начало репликации мтДНК специфично для клеток трофэктодерма.[26] Напротив, клетки внутренняя клеточная масса ограничивают репликацию мтДНК, пока они не получат сигналы к различать к определенным типам клеток ».[26]

Гены на мтДНК и их транскрипция
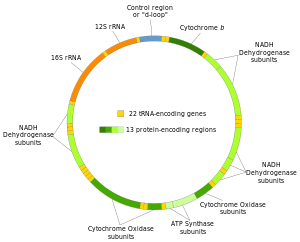
Две цепи митохондриальной ДНК человека различаются как тяжелая цепь и легкая цепь. Тяжелая цепь богата гуанином и кодирует 12 субъединиц системы окислительного фосфорилирования, две рибосомные РНК (12S и 16S) и 14 тРНК. Легкая цепь кодирует одну субъединицу и 8 тРНК. Итак, в целом мтДНК кодирует две рРНК, 22 тРНК и 13 белковых субъединиц, все из которых участвуют в процессе окислительного фосфорилирования.[28][29]
| Ген | Тип | Товар | Позиции в митогеноме | Strand |
|---|---|---|---|---|
| MT-ATP8 | кодирование белков | АТФ-синтаза, Субъединица 8 Fo (комплекс V) | 08,366–08,572 (перекрывается с MT-ATP6) | ЧАС |
| MT-ATP6 | кодирование белков | АТФ-синтаза, Субъединица 6 Fo (комплекс V) | 08,527–09,207 (перекрывается с MT-ATP8) | ЧАС |
| MT-CO1 | кодирование белков | Цитохром с оксидаза, субъединица 1 (комплекс IV) | 05,904–07,445 | ЧАС |
| MT-CO2 | кодирование белков | Цитохром с оксидаза, субъединица 2 (комплекс IV) | 07,586–08,269 | ЧАС |
| MT-CO3 | кодирование белков | Цитохром с оксидаза, субъединица 3 (комплекс IV) | 09,207–09,990 | ЧАС |
| MT-CYB | кодирование белков | Цитохром b (комплекс III) | 14,747–15,887 | ЧАС |
| МТ-НД1 | кодирование белков | НАДН-дегидрогеназа, субъединица 1 (комплекс I) | 03,307–04,262 | ЧАС |
| МТ-НД2 | кодирование белков | НАДН-дегидрогеназа, субъединица 2 (комплекс I) | 04,470–05,511 | ЧАС |
| MT-ND3 | кодирование белков | НАДН-дегидрогеназа, субъединица 3 (комплекс I) | 10,059–10,404 | ЧАС |
| MT-ND4L | кодирование белков | НАДН-дегидрогеназа, субъединица 4L (комплекс I) | 10 470–10 766 (перекрывается с MT-ND4) | ЧАС |
| МТ-НД4 | кодирование белков | НАДН-дегидрогеназа, субъединица 4 (комплекс I) | 10,760–12,137 (перекрывается с MT-ND4L) | ЧАС |
| MT-ND5 | кодирование белков | НАДН-дегидрогеназа, субъединица 5 (комплекс I) | 12,337–14,148 | ЧАС |
| MT-ND6 | кодирование белков | НАДН-дегидрогеназа, субъединица 6 (комплекс I) | 14,149–14,673 | L |
| МТ-РНР2 | кодирование белков | Humanin | — | — |
| MT-TA | переносить РНК | тРНК-Аланин (Аля или А) | 05,587–05,655 | L |
| MT-TR | переносить РНК | тРНК-Аргинин (Arg или R) | 10,405–10,469 | ЧАС |
| MT-TN | переносить РНК | тРНК-Аспарагин (Asn или N) | 05,657–05,729 | L |
| МТ-ТД | переносить РНК | тРНК-Аспарагиновая кислота (Asp или D) | 07,518–07,585 | ЧАС |
| MT-TC | переносить РНК | тРНК-Цистеин (Cys или C) | 05,761–05,826 | L |
| MT-TE | переносить РНК | тРНК-Глютаминовая кислота (Glu или E) | 14,674–14,742 | L |
| MT-TQ | переносить РНК | тРНК-Глутамин (Gln или Q) | 04,329–04,400 | L |
| МТ-ТГ | переносить РНК | тРНК-Глицин (Gly или G) | 09,991–10,058 | ЧАС |
| MT-TH | переносить РНК | тРНК-Гистидин (Его или H) | 12,138–12,206 | ЧАС |
| MT-TI | переносить РНК | тРНК-Изолейцин (Иль или я) | 04,263–04,331 | ЧАС |
| MT-TL1 | переносить РНК | тРНК-Лейцин (Leu-UUR или L) | 03,230–03,304 | ЧАС |
| MT-TL2 | переносить РНК | тРНК-Лейцин (Leu-CUN или L) | 12,266–12,336 | ЧАС |
| МТ-ТК | переносить РНК | тРНК-Лизин (Lys или K) | 08,295–08,364 | ЧАС |
| МТ-ТМ | переносить РНК | тРНК-Метионин (Встретились или М) | 04,402–04,469 | ЧАС |
| MT-TF | переносить РНК | тРНК-Фенилаланин (Phe или F) | 00,577–00,647 | ЧАС |
| МТ-ТП | переносить РНК | тРНК-Пролин (Pro или P) | 15,956–16,023 | L |
| MT-TS1 | переносить РНК | тРНК-Серин (Ser-UCN или S) | 07,446–07,514 | L |
| МТ-ТС2 | переносить РНК | тРНК-Серин (Ser-AGY или S) | 12,207–12,265 | ЧАС |
| МТ-ТТ | переносить РНК | тРНК-Треонин (Thr или T) | 15,888–15,953 | ЧАС |
| MT-TW | переносить РНК | тРНК-Триптофан (Trp или W) | 05,512–05,579 | ЧАС |
| MT-TY | переносить РНК | тРНК-Тирозин (Тюр или Y) | 05,826–05,891 | L |
| МТ-ТВ | переносить РНК | тРНК-Валин (Вал или В) | 01,602–01,670 | ЧАС |
| МТ-РНР1 | рибосомная РНК | Малое подразделение: СБУ (12С) | 00,648–01,601 | ЧАС |
| МТ-РНР2 | рибосомная РНК | Большой блок: LSU (16S) | 01,671–03,229 | ЧАС |
Между большинством (но не всеми) белок-кодирующими регионами присутствуют тРНК (см. карта митохондриального генома человека ). Во время транскрипции тРНК приобретают характерную L-форму, которая распознается и расщепляется специфическими ферментами. При процессинге митохондриальной РНК отдельные последовательности мРНК, рРНК и тРНК высвобождаются из первичного транскрипта.[31] Таким образом, свернутые тРНК действуют как пунктуации вторичной структуры.[32]
Регулирование транскрипции
Промоторы для инициации транскрипции тяжелой и легкой цепей расположены в основной некодирующей области мтДНК, называемой петлей смещения, D-петлей.[28] Имеются данные о том, что транскрипция митохондриальных рРНК регулируется промотором 1 тяжелой цепи (HSP1), а транскрипция полицистронных транскриптов, кодирующих белковые субъединицы, регулируется HSP2.[28]
Измерение уровней РНК, кодируемых мтДНК, в тканях крупного рогатого скота показало, что существуют большие различия в экспрессии митохондриальных РНК по сравнению с общей тканевой РНК.[33] Среди 12 исследованных тканей самый высокий уровень экспрессии наблюдался в сердце, за которым следовали образцы мозга и стероидогенных тканей.[33]
Что демонстрирует действие трофического гормона АКТГ на клетках коры надпочечников экспрессия митохондриальных генов может сильно регулироваться внешними факторами, по-видимому, для усиления синтеза митохондриальных белков, необходимых для производства энергии.[33] Интересно, что в то время как экспрессия генов, кодирующих белок, стимулировалась АКТГ, уровни митохондриальной 16S рРНК не показали значительных изменений.[33]
Митохондриальное наследование
В большинстве многоклеточные организмы, мтДНК наследуется от матери (по материнской линии). Механизмы для этого включают простое разведение (яйцо содержит в среднем 200000 молекул мтДНК, тогда как здоровый человек сперма сообщается, что он содержит в среднем 5 молекул),[34][35] деградация мтДНК сперматозоидов в мужских половых путях и в оплодотворенной яйцеклетке; и, по крайней мере, у некоторых организмов, неспособность мтДНК сперматозоидов проникнуть в яйцеклетку. Каким бы ни был механизм, этот единственный родитель (однопородное наследование ) паттерн наследования мтДНК встречается у большинства животных, большинства растений, а также у грибов.
В исключительных случаях человеческие младенцы иногда наследуют мтДНК как от отца, так и от матери, что приводит к образованию мтДНК. гетероплазмия.[36]
Женское наследство
В половое размножение митохондрии обычно наследуются исключительно от матери; митохондрии в сперме млекопитающих обычно разрушаются яйцеклеткой после оплодотворения. Кроме того, митохондрии находятся только в хвосте сперматозоидов, который используется для продвижения сперматозоидов, и иногда хвост теряется во время оплодотворения. В 1999 г. сообщалось, что митохондрии отцовского сперматозоида (содержащие мтДНК) помечены убиквитин чтобы выбрать их для последующего уничтожения внутри эмбрион.[37] Немного in vitro методы оплодотворения, в частности, введение спермы в ооцит, может помешать этому.
Тот факт, что митохондриальная ДНК передается по материнской линии, позволяет генеалогический исследователи проследить материнская линия давным-давно. (Y-хромосомная ДНК наследуется по отцовской линии, используется аналогичным образом для определения патрилинейный истории.) Обычно это делается на митохондриальная ДНК человека путем упорядочивания гипервариабельные контрольные области (HVR1 или HVR2), а иногда и целую молекулу митохондриальной ДНК, как генеалогический ДНК-тест.[38] HVR1, например, состоит примерно из 440 пар оснований. Эти 440 пар оснований сравниваются с теми же регионами других людей (либо конкретных людей, либо субъектов в базе данных), чтобы определить материнское происхождение. Чаще всего сравнивают с исправленными Кембриджская эталонная последовательность. Вила и другие. опубликовали исследования, отслеживающие материнское происхождение домашних собак от волков.[39]Концепция Митохондриальная Ева основан на том же анализе, пытаясь обнаружить происхождение человечество отслеживая родословную во времени.
Митохондриальное узкое место
Можно ожидать, что объекты, подверженные однопородному наследованию и практически не имеющие рекомбинации, будут подвергаться Трещотка Мюллера, накопление вредных мутаций до потери функциональности. Популяции животных митохондрий избегают этого благодаря процессу развития, известному как узкое место мтДНК. Эксплойты узких мест случайные процессы в клетке для увеличения межклеточной изменчивости в мутантный груз по мере развития организма: одна яйцеклетка с некоторой долей мутантной мтДНК, таким образом, дает эмбрион, в котором разные клетки имеют разные мутантные нагрузки. Затем отбор на клеточном уровне может действовать для удаления этих клеток с большим количеством мутантной мтДНК, что приводит к стабилизации или снижению мутантной нагрузки между поколениями. Обсуждается механизм, лежащий в основе узкого места,[40][41][42][43] с недавним математическим и экспериментальным метаисследованием, предоставившим доказательства комбинации случайного разделения мтДНК при делении клетки и случайного оборота молекул мтДНК внутри клетки.[27]
Наследование по мужскому типу
Наследование мужской митохондриальной ДНК было обнаружено в Куры Плимут Рок.[44] Доказательства подтверждают редкие случаи мужской митохондриальной наследования у некоторых млекопитающих. В частности, зарегистрированные случаи существуют для мышей,[45][46] где митохондрии, унаследованные от мужчин, впоследствии были отвергнуты. Он также был обнаружен у овец,[47] и клонированного крупного рогатого скота.[48] Зарегистрированы редкие случаи мужской митохондриальной наследования у людей.[49][50][51][52] Хотя многие из этих случаев связаны с клонированными эмбрионами или последующим отторжением отцовских митохондрий, другие документируют in vivo наследование и настойчивость в лабораторных условиях.
У двустворчатых моллюсков наблюдается двустворчатое наследование мтДНК. У этих видов самки имеют только один тип мтДНК (F), тогда как самцы имеют мтДНК F-типа в своих соматических клетках, но мтДНК M-типа (которая может отличаться на 30%) в соматических клетках. зародышевый клетки.[53] Унаследованные по отцу митохондрии также были зарегистрированы у некоторых насекомых, таких как плодовые мошки,[54][55] пчелы,[56] и периодические цикады.[57]
Донорство митохондрий
Методика ЭКО, известная как донорство митохондрий или митохондриальная заместительная терапия (MRT), приводит к получению потомства, содержащего мтДНК от женщины-донора и ядерную ДНК от матери и отца. В процедуре переноса веретена ядро яйцеклетки вставляется в цитоплазму яйцеклетки самки-донора, ядро которой было удалено, но все еще содержит мтДНК самки-донора. Затем составная яйцеклетка оплодотворяется спермой мужчины. Процедура применяется, когда женщина с генетически дефектные митохондрии желает произвести потомство со здоровыми митохондриями.[58] Первым известным ребенком, родившимся в результате донорства митохондрий, был мальчик, родившийся у иорданской пары в Мексике 6 апреля 2016 года.[59]
Мутации и болезни
Восприимчивость
Представление о том, что мтДНК особенно чувствительна к активные формы кислорода генерируется дыхательная цепь из-за своей близости остается спорным.[60] мтДНК не накапливает больше окислительных повреждений оснований, чем ядерная ДНК.[61] Сообщалось, что по крайней мере некоторые типы окислительных повреждений ДНК восстанавливаются более эффективно в митохондриях, чем в ядре.[62] мтДНК упакована с белками, которые кажутся такими же защитными, как белки ядерного хроматина.[63] Более того, митохондрии развили уникальный механизм, который поддерживает целостность мтДНК за счет деградации чрезмерно поврежденных геномов с последующей репликацией интактной / отремонтированной мтДНК. Этот механизм отсутствует в ядре и активируется множественными копиями мтДНК, присутствующими в митохондриях.[64] Результатом мутации в мтДНК может быть изменение инструкций по кодированию некоторых белков,[65] которые могут влиять на метаболизм и / или физическую форму организма.
Генетическая болезнь
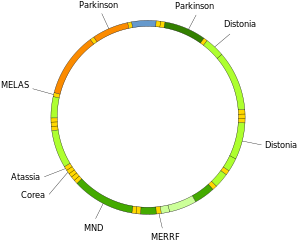
Мутации митохондриальной ДНК могут привести к ряду заболеваний, включая: непереносимость физических упражнений и Синдром Кирнса – Сайра (KSS), из-за которого человек теряет полноценную функцию сердца, глаз и движений мышц. Некоторые данные свидетельствуют о том, что они могут вносить основной вклад в процесс старения и возрастные патологии.[66] В частности, в контексте заболевания пропорция мутантных молекул мтДНК в клетке называется гетероплазмия. Внутриклеточное и межклеточное распределение гетероплазмии определяет начало и тяжесть заболевания.[67] и находятся под влиянием сложных случайные процессы внутри клетки и во время развития.[27][68]
Мутации в митохондриальных тРНК могут быть причиной серьезных заболеваний, таких как МЕЛАС и синдромы MERRF.[69]
Мутации в ядерных генах, кодирующих белки, которые используют митохондрии, также могут способствовать митохондриальным заболеваниям. Эти заболевания не следуют паттернам митохондриального наследования, а вместо этого следуют паттернам менделевского наследования.[70]
Использование в диагностике болезней
Недавно мутация мтДНК была использована для диагностики рака простаты у пациентов с отрицательным биопсия простаты.[71][72]Изменения мтДНК можно обнаружить в биологических жидкостях больных раком.[73]
Связь со старением
Хотя идея спорна, некоторые данные свидетельствуют о связи между старением и дисфункцией митохондриального генома.[74] По сути, мутации в мтДНК нарушают тщательный баланс активные формы кислорода (ROS) производство и ферментативное поглощение ROS (ферментами, такими как супероксиддисмутаза, каталаза, глутатионпероксидаза и другие). Однако некоторые мутации, которые увеличивают выработку АФК (например, за счет снижения антиоксидантной защиты) у червей, увеличивают, а не уменьшают их продолжительность жизни.[60] Также, голый землекоп, грызуны о размере мышей, живут примерно в восемь раз дольше, чем мыши, несмотря на снижение по сравнению с мышами антиоксидантной защиты и повышенное окислительное повреждение биомолекул.[75] Когда-то считалось, что действует цикл положительной обратной связи («порочный цикл»); поскольку митохондриальная ДНК накапливает генетические повреждения, вызванные свободными радикалами, митохондрии теряют функцию и пропускают свободные радикалы в цитозоль. Снижение митохондриальной функции снижает общую метаболическую эффективность.[76] Однако эта концепция была окончательно опровергнута, когда было продемонстрировано, что мыши, которые были генетически изменены для ускоренного накопления мутаций мтДНК, действительно преждевременно стареют, но их ткани не производят больше АФК, как предсказывает гипотеза «порочного цикла».[77] Подтверждая связь между долголетием и митохондриальной ДНК, некоторые исследования обнаружили корреляцию между биохимическими свойствами митохондриальной ДНК и продолжительностью жизни видов.[78] В настоящее время проводятся обширные исследования для дальнейшего изучения этой связи и методов борьбы со старением. На данный момент, генная терапия и нутрицевтический добавки - популярные области продолжающихся исследований.[79][80] Bjelakovic et al. проанализировали результаты 78 исследований с 1977 по 2012 год, в которых участвовало в общей сложности 296 707 участников, и пришли к выводу, что антиоксидантные добавки не снижают общую смертность и не продлевают продолжительность жизни, в то время как некоторые из них, такие как бета-каротин, витамин E и более высокие дозы витамина А, может фактически увеличить смертность.[81]
Нейродегенеративные заболевания
Повышенная мтПовреждение ДНК это особенность нескольких нейродегенеративные заболевания.
Мозг людей с Болезнь Альцгеймера имеют повышенный уровень окислительное повреждение ДНК в обоих ядерная ДНК и мтДНК, но мтДНК имеет примерно в 10 раз более высокие уровни, чем ядерная ДНК.[82] Было предложено, чтобы в возрасте митохондрии является решающим фактором в возникновении нейродегенерации при болезни Альцгеймера.[83]
В Болезнь Хантингтона, мутант белок хантингтин вызывает дисфункцию митохондрий, включая ингибирование митохондриальной электронный транспорт, более высокие уровни активные формы кислорода и увеличился окислительный стресс.[84] Мутантный белок хантингтин способствует окислительному повреждению мтДНК, а также ядерной ДНК, что может способствовать развитию болезни Хантингтона. патология.[85]
В Окисление ДНК товар 8-оксогуанин (8-oxoG) - хорошо известный маркер окислительного повреждения ДНК. У лиц с боковой амиотрофический склероз (БАС), ферменты, которые обычно восстанавливают повреждения ДНК 8-oxoG в мтДНК спинного мозга. двигательные нейроны ослаблены.[86] Таким образом, окислительное повреждение мтДНК мотонейронов может быть важным фактором этиология БАС.
Корреляция базового состава мтДНК с продолжительностью жизни животных
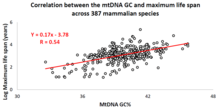
За последнее десятилетие израильская исследовательская группа под руководством профессора Вадима Фрайфельда показала, что сильные и значимые корреляции существуют между базовым составом мтДНК и максимальной продолжительностью жизни, зависящей от вида животных.[87][88][89] Как показано в их работе, более высокая мтДНК гуанин + цитозин содержание (GC% ) прочно ассоциируется с более длинными максимальная продолжительность жизни среди видов животных. Дополнительное наблюдение состоит в том, что корреляция GC% мтДНК с максимальной продолжительностью жизни не зависит от хорошо известной корреляции между скоростью метаболизма у животных и максимальной продолжительностью жизни. GC% мтДНК и скорость метаболизма в состоянии покоя объясняют различия в максимальной продолжительности жизни видов животных мультипликативным образом (т.е. максимальная продолжительность жизни видов = их GC% мтДНК * скорость метаболизма).[88] Чтобы поддержать научное сообщество в проведении сравнительного анализа характеристик мтДНК и продолжительности жизни животных, была создана специальная база данных под названием MitoAge.[90]
Связь с не-B (неканоническими) структурами ДНК
Точки разрыва при удалении часто встречаются внутри или рядом с областями, показывающими неканонические (не-B) конформации, а именно шпильки, крестообразные элементы и элементы, похожие на клеверный лист.[91] Более того, есть данные, подтверждающие участие искажающих спираль искривленных областей и длинных G-тетрад в возникновении событий нестабильности. Кроме того, более высокие плотности точек разрыва постоянно наблюдались в областях с асимметрией GC и в непосредственной близости от мотива вырожденной последовательности YMMYMNNMMHM.[92]
Использование в криминалистике
В отличие от ядерной ДНК, которая наследуется от обоих родителей и в которой гены перестраиваются в процессе рекомбинация, мтДНК от родителей к потомкам обычно не меняется. Хотя мтДНК также рекомбинирует, она делает это с собственными копиями в одной и той же митохондрии. Из-за этого и потому что скорость мутации мтДНК животных выше, чем ядерная ДНК,[93] мтДНК - мощный инструмент для отслеживания происхождения от самок (материнство ) и использовался в этой роли для отслеживания происхождения многих видов на протяжении сотен поколений.
Высокая скорость мутации (у животных) делает мтДНК полезной для оценки генетических взаимоотношений индивидов или групп внутри вида, а также для идентификации и количественной оценки филогении (эволюционные отношения; см. филогенетика ) среди разных видов. Для этого биологи определяют и затем сравнивают последовательности мтДНК у разных людей или видов. Данные сравнений используются для построения сети взаимоотношений между последовательностями, которая обеспечивает оценку взаимоотношений между людьми или видами, от которых были взяты мтДНК. мтДНК можно использовать для оценки взаимоотношений как между близкородственными, так и между отдаленно родственными видами. Из-за высокой скорости мутаций мтДНК у животных 3-е положения кодонов меняются относительно быстро и, таким образом, предоставляют информацию о генетических расстояниях между близкородственными особями или видами. С другой стороны, скорость замены mt-белков очень низкая, поэтому аминокислотные изменения накапливаются медленно (с соответствующими медленными изменениями в положениях 1-го и 2-го кодона), и, таким образом, они предоставляют информацию о генетических расстояниях отдаленно родственных видов. Таким образом, статистические модели, которые обрабатывают частоту замен между положениями кодонов отдельно, могут использоваться для одновременной оценки филогении, которые содержат как близкородственные, так и отдаленные виды.[69]
Митохондриальная ДНК впервые была допущена к доказательствам в зале суда США в 1996 году во время Штат Теннесси против Пола Уэра.[94]
В деле 1998 года в суде Соединенных Штатов по делу Содружество Пенсильвании против Патрисии Линн Роррер,[95] митохондриальная ДНК впервые была допущена к доказательствам в штате Пенсильвания.[96][97] Дело было показано в 55 серии 5 сезона криминального сериала. Файлы судебной экспертизы (сезон 5).[98]
Митохондриальная ДНК впервые была допущена в качестве доказательства в Калифорния, США, в успешном судебном преследовании Дэвида Вестерфилда за похищение и убийство 7-летнего мальчика в 2002 г. Даниэль ван Дам в Сан Диего: он использовался как для идентификации человека, так и для собаки.[99] Это было первое испытание в США, признавшее собачью ДНК.[100]
Остатки Король Ричард III были идентифицированы путем сравнения его мтДНК с мтДНК двух матрилинейных потомков его сестры.[101]
Использование в эволюционной биологии и систематической биологии
мтДНК сохраняется во всем эукариотическом организме, учитывая критическую роль митохондрий в клеточное дыхание. Однако из-за менее эффективной репарации ДНК (по сравнению с ядерной ДНК) она имеет относительно высокую скорость мутации (но медленную по сравнению с другими участками ДНК, такими как микроспутники ), что делает его полезным для изучения эволюционных отношений -филогения - организмов. Биологи могут определять, а затем сравнивать последовательности мтДНК у разных видов и использовать сравнения для построения эволюционное дерево для исследованных видов.
Например, в то время как большинство ядерные гены почти идентичны между людьми и шимпанзе их митохондриальные геномы отличаются на 9,8%. Человек и горилла митохондриальные геномы различаются на 11,8%, показывая, что мы более тесно связаны с шимпанзе, чем с гориллами.[102]
История
Митохондриальная ДНК была открыта в 1960-х годах Маргит М. К. Насс и Сильван Насс. электронная микроскопия как чувствительные к ДНКазе нити внутри митохондрий,[103] и Эллен Хаслбруннер, Ханс Таппи и Готфрид Шац биохимическим анализом на высокоочищенных фракциях митохондрий.[104]
Базы данных митохондриальных последовательностей
Было создано несколько специализированных баз данных для сбора последовательностей митохондриального генома и другой информации. Хотя большинство из них сосредоточено на данных о последовательностях, некоторые из них включают филогенетическую или функциональную информацию.
- AmtDB: база данных древних митохондриальных геномов человека.[105]
- InterMitoBase: аннотированная база данных и платформа для анализа белок-белковых взаимодействий митохондрий человека.[106] (очевидно, последний раз обновлялся в 2010 году, но все еще доступен)
- MitoBreak: база данных точек разрыва митохондриальной ДНК.[107]
- MitoFish и MitoAnnotator: база данных митохондриального генома рыб.[108] См. Также Cawthorn et al.[109]
- Митоме: база данных для сравнительной митохондриальной геномики у многоклеточных животных[110] (больше недоступно)
- MitoRes: ресурс кодируемых ядром митохондриальных генов и их продуктов в многоклеточных[111] (видимо больше не обновляется)
- MitoSatPlant: База данных митохондриальных микросателлитов viridiplantae.[112]
- MitoZoa 2.0: база данных для сравнительного и эволюционного анализа митохондриальных геномов Metazoa.[113] (больше недоступно)
Базы данных митохондриальных мутаций
Существует несколько специализированных баз данных, в которых сообщается о полиморфизмах и мутациях в митохондриальной ДНК человека, а также об оценке их патогенности.
- MitImpact: Коллекция предварительно рассчитанных прогнозов патогенности для всех нуклеотидных изменений, которые вызывают несинонимичные замены в генах, кодирующих митохондриальные белки человека. [3].
- MITOMAP: Сборник полиморфизмов и мутаций митохондриальной ДНК человека. [4].
Смотрите также
- Clade
- Гипотеза CoRR
- Гаплогруппа
- Гетероплазмия
- Гаплогруппа митохондриальной ДНК человека
- Митохондриальная генетика человека
- Митохондриальная болезнь
- Митохондриальная ДНК (журнал)
- Митохондриальная Ева
- Митохондриальный rCRS
- Отцовская передача мтДНК
- Теория единого происхождения
- Сверхскопление (генетическое)
- Комплекс ТИМ / ТОМ
использованная литература
- ^ Зикевиц П. (1957). «Электростанция клетки». Scientific American. 197 (1): 131–40. Bibcode:1957SciAm.197a.131S. Дои:10.1038 / scientificamerican0757-131.
- ^ Иборра Ф.Дж., Кимура Х., Кук PR (май 2004 г.). «Функциональная организация митохондриальных геномов в клетках человека». BMC Биология. 2: 9. Дои:10.1186/1741-7007-2-9. ЧВК 425603. PMID 15157274.
- ^ Сайкс Б. (10 сентября 2003 г.). «Митохондриальная ДНК и история человечества». Геном человека. Wellcome Trust. Архивировано из оригинал 7 сентября 2015 г.. Получено 5 февраля 2012.
- ^ Андерсон С., Банкир А.Т., Баррелл Б.Г., де Брюин М.Х., Колсон А.Р., Друин Дж., Эперон И.К., Нирлих Д.П., Роу Б.А., Сэнгер Ф., Шрайер П.Х., Смит А.Дж., Стаден Р., Янг И.Г. (1981). «Последовательность и организация митохондриального генома человека». Природа. 290 (5806): 457–65. Bibcode:1981Натура.290..457A. Дои:10.1038 / 290457a0. PMID 7219534. S2CID 4355527.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Бурсо П., Боном Ф. (1 января 1986 г.). "[Нет в наличии]". Génétique, Sélection, Évolution. 18 (1): 73–98. Дои:10.1186/1297-9686-18-1-73. ЧВК 2713894. PMID 22879234.
- ^ Delsuc F, Stanhope MJ, Douzery EJ (август 2003 г.). «Молекулярная систематика броненосцев (Xenarthra, Dasypodidae): вклад метода максимального правдоподобия и байесовского анализа митохондриальных и ядерных генов». Молекулярная филогенетика и эволюция. 28 (2): 261–75. Дои:10.1016 / с1055-7903 (03) 00111-8. PMID 12878463.
- ^ Хассанин А., Ан Дж., Ропике А., Нгуен Т. Т., Кулу А. (март 2013 г.). «Объединение нескольких аутосомных интронов для изучения мелкой филогении и таксономии млекопитающих Laurasiatherian: приложение к трибе Bovini (Cetartiodactyla, Bovidae)». Молекулярная филогенетика и эволюция. 66 (3): 766–75. Дои:10.1016 / j.ympev.2012.11.003. PMID 23159894.
- ^ а б c Джонстон И.Г., Уильямс ВР (февраль 2016 г.). «Эволюционный вывод эукариот определяет специфические факторы давления, способствующие удержанию митохондриальных генов». Сотовые системы. 2 (2): 101–11. Дои:10.1016 / j.cels.2016.01.013. PMID 27135164.
- ^ ван дер Гизен М, Товар Дж, Кларк К.Г. (2005). «Органеллы, полученные из митохондрий у протистов и грибов». Обзор клеточной биологии. Международный обзор цитологии. 244. С. 175–225. Дои:10.1016 / S0074-7696 (05) 44005-X. ISBN 978-0-12-364648-4. PMID 16157181.
- ^ Адамс К.Л., Палмер Дж. Д. (декабрь 2003 г.). «Эволюция содержания митохондриальных генов: потеря гена и перенос в ядро». Молекулярная филогенетика и эволюция. 29 (3): 380–95. Дои:10.1016 / S1055-7903 (03) 00194-5. PMID 14615181.
- ^ Бьоркхольм П., Хариш А., Хагстрём Э., Эрнст А. М., Андерссон С. Г. (август 2015 г.). «Митохондриальные геномы сохраняются за счет избирательных ограничений нацеливания на белок». Труды Национальной академии наук Соединенных Штатов Америки. 112 (33): 10154–61. Bibcode:2015ПНАС..11210154Б. Дои:10.1073 / pnas.1421372112. ЧВК 4547212. PMID 26195779.
- ^ Аллен Дж. Ф. (август 2015 г.). «Почему хлоропласты и митохондрии сохраняют свои собственные геномы и генетические системы: колокация для окислительно-восстановительной регуляции экспрессии генов». Труды Национальной академии наук Соединенных Штатов Америки. 112 (33): 10231–8. Bibcode:2015ПНАС..11210231А. Дои:10.1073 / pnas.1500012112. ЧВК 4547249. PMID 26286985.
- ^ а б Колесников А.А., Герасимов Е.С. (декабрь 2012 г.). «Разнообразие организации митохондриального генома». Биохимия. Биохимия. 77 (13): 1424–35. Дои:10.1134 / S0006297912130020. PMID 23379519. S2CID 14441187.
- ^ Носек Дж., Томаска Л., Фукухара Х., Суяма Й., Ковач Л. (май 1998 г.). «Линейные митохондриальные геномы: 30 лет спустя». Тенденции в генетике. 14 (5): 184–8. Дои:10.1016 / S0168-9525 (98) 01443-7. PMID 9613202.
- ^ Лавров, Денис В .; Петт, Уокер (26 сентября 2016 г.). "Митохондриальная ДНК животных в том виде, в каком мы ее не знаем: организация и эволюция mt-генома в небилатериальных линиях". Геномная биология и эволюция. 8 (9): 2896–2913. Дои:10.1093 / gbe / evw195. ISSN 1759-6653. ЧВК 5633667. PMID 27557826.
- ^ Stampar, Sérgio N .; Бро, Майкл Б .; Макрандер, Джейсон; Reitzel, Adam M .; Brugler, Mercer R .; Дэли, Мэримеган (15 апреля 2019 г.). «Линейный митохондриальный геном у Anthozoa (Cnidaria): пример из Ceriantharia». Научные отчеты. 9. Дои:10.1038 / s41598-019-42621-z. ISSN 2045-2322. ЧВК 6465557. PMID 30988357.
- ^ Яхаломи, Даяна; Аткинсон, Стивен Д .; Нойхоф, Моран; Чанг, Э. Салли; Филипп, Эрве; Картрайт, Полин; Bartholomew, Jerri L .; Хюшон, Дороти (10 марта 2020 г.). "Книдарийный паразит лосося (Myxozoa: Хеннегуя) отсутствует митохондриальный геном ". Труды Национальной академии наук. 117 (10): 5358–5363. Дои:10.1073 / pnas.1909907117. ЧВК 7071853. PMID 32094163.
- ^ Старр, Мишель. «Ученые нашли первое в истории животное, которому для выживания не нужен кислород». ScienceAlert. Получено 25 февраля 2020.
- ^ Sloan DB, Alverson AJ, Chuckalovcak JP, Wu M, McCauley DE, Palmer JD, Taylor DR (январь 2012 г.). «Быстрая эволюция огромных мультихромосомных геномов в митохондриях цветковых растений с исключительно высокой частотой мутаций». PLOS Биология. 10 (1): e1001241. Дои:10.1371 / journal.pbio.1001241. ЧВК 3260318. PMID 22272183.
- ^ Уорд Б.Л., Андерсон Р.С., Бендич А.Дж. (сентябрь 1981 г.). «Митохондриальный геном большой и вариабельный в семействе растений (тыквенные)». Ячейка. 25 (3): 793–803. Дои:10.1016/0092-8674(81)90187-2. PMID 6269758. S2CID 45090891.
- ^ Алверсон А.Дж., Райс Д.В., Дикинсон С., Барри К., Палмер Дж. Д. (июль 2011 г.). «Происхождение и рекомбинация мультихромосомного митохондриального генома огурца размером с бактерию». Растительная клетка. 23 (7): 2499–513. Дои:10.1105 / tpc.111.087189. JSTOR 41433488. ЧВК 3226218. PMID 21742987.
- ^ «Митохондриальная ДНК (мтДНК)» (PDF). Интегрированные ДНК-технологии. Архивировано из оригинал (PDF) 29 июля 2016 г.. Получено 25 февраля 2016.
- ^ Tyagi S, Pande V, Das A (февраль 2014 г.). «Полная последовательность митохондриального генома индийского полевого изолята Plasmodium falciparum». Корейский журнал паразитологии. 52 (1): 99–103. Дои:10.3347 / kjp.2014.52.1.99. ЧВК 3949004. PMID 24623891.
- ^ Якубовская Е., Чен З., Карродегуас Дж. А., Кискер С., Богенхаген Д. Ф. (январь 2006 г.). «Функциональная гамма-гамма митохондриальной ДНК-полимеразы человека образует гетеротример». Журнал биологической химии. 281 (1): 374–82. Дои:10.1074 / jbc.M509730200. PMID 16263719.
- ^ Джемт Э., Фарге Дж., Бэкстрём С., Холмлунд Т., Густафссон С.М., Фалькенберг М (Ноябрь 2011 г.). «Митохондриальная ДНК-геликаза TWINKLE может собираться на замкнутой кольцевой матрице и поддерживать инициацию синтеза ДНК». Исследования нуклеиновых кислот. 39 (21): 9238–49. Дои:10.1093 / нар / gkr653. ЧВК 3241658. PMID 21840902.
- ^ а б c Сент-Джон Дж. С., Факучо-Оливейра Дж., Цзян Ю., Келли Р., Салах Р. (2010). «Передача, репликация и наследование митохондриальной ДНК: путь от гаметы через эмбрион к потомству и эмбриональным стволовым клеткам». Обновление репродукции человека. 16 (5): 488–509. Дои:10.1093 / humupd / dmq002. PMID 20231166.
- ^ а б c Джонстон И.Г., Бургшталлер Дж. П., Хавличек В., Кольбе Т., Рюликке Т., Брем Дж., Поултон Дж., Джонс Н. С. (июнь 2015 г.). «Стохастическое моделирование, байесовский вывод и новые измерения in vivo проливают свет на обсуждаемый механизм узкого места мтДНК». eLife. 4: e07464. Дои:10.7554 / eLife.07464. ЧВК 4486817. PMID 26035426.
- ^ а б c Баршад Г., Маром С., Коэн Т., Мишмар Д. (2018). «Транскрипция митохондриальной ДНК и ее регуляция: эволюционная перспектива». Тенденции Genet. 34 (9): 682–692. Дои:10.1016 / j.tig.2018.05.009. PMID 29945721.
- ^ Barchiesi A, Vascotto C (2019). «Транскрипция, обработка и распад митохондриальной РНК при здоровье и болезнях». Int J Mol Sci. 20 (9): 2221. Дои:10.3390 / ijms20092221. ЧВК 6540609. PMID 31064115.
- ^ Homo sapiens митохондрия, полный геном. «Пересмотренная Кембриджская эталонная последовательность (rCRS): номер доступа NC_012920», Национальный центр биотехнологической информации. Проверено 20 февраля, 2017.
- ^ Фалькенберг М., Ларссон Н.Г., Густафссон К.М. (19 июня 2007 г.). «Репликация и транскрипция ДНК в митохондриях млекопитающих». Ежегодный обзор биохимии. 76 (1): 679–99. Дои:10.1146 / annurev.biochem.76.060305.152028. PMID 17408359.
- ^ Охала Д., Монтойя Дж., Аттарди Дж. (Апрель 1981 г.). «Модель пунктуации тРНК процессинга РНК в митохондриях человека». Природа. 290 (5806): 470–4. Bibcode:1981Натура.290..470O. Дои:10.1038 / 290470a0. PMID 7219536. S2CID 4323371.
- ^ а б c d Райхинштейн М., Ханукоглу И. (ноябрь 1993 г.). «РНК, кодируемые митохондриальным геномом: дифференциальная регуляция кортикотропином в клетках коры надпочечников крупного рогатого скота». Труды Национальной академии наук Соединенных Штатов Америки. 90 (22): 10509–13. Bibcode:1993ПНАС ... 9010509Р. Дои:10.1073 / пнас.90.22.10509. ЧВК 47806. PMID 7504267.
- ^ Wolff JN, Gemmell NJ (ноябрь 2008 г.). «Потерянный в зиготе: разведение отцовской мтДНК при оплодотворении». Наследственность. 101 (5): 429–34. Дои:10.1038 / hdy.2008.74. PMID 18685570. S2CID 5065133.
- ^ Габриэль М.С., Чан С.В., Алхатал Н., Чен Дж. З., Зини А. (август 2012 г.). «Влияние микрохирургической варикоцелэктомии на количество копий митохондриальной ДНК спермы человека: пилотное исследование». Журнал вспомогательной репродукции и генетики. 29 (8): 759–64. Дои:10.1007 / s10815-012-9785-z. ЧВК 3430774. PMID 22562241.
- ^ Луо С., Валенсия, Калифорния, Чжан Дж., Ли NC, Слоне Дж., Гуй Б., Ван Х, Ли З, Делл С., Браун Дж., Чен С. М., Чиен Й.Х., Хву В.Л., Фан-ПК, Вонг Л.Дж., Атвал П.С., Хуанг Т. (Декабрь 2018 г.). «Наследование митохондриальной ДНК у человека от двух родителей». Труды Национальной академии наук Соединенных Штатов Америки. 115 (51): 13039–13044. Дои:10.1073 / pnas.1810946115. ЧВК 6304937. PMID 30478036.
- ^ Сутовский П., Морено Р.Д., Рамальо-Сантос Дж., Доминко Т., Симерли С., Шаттен Дж. (Ноябрь 1999 г.). «Убиквитиновая метка для митохондрий сперматозоидов». Природа. 402 (6760): 371–2. Bibcode:1999Натура.402..371С. Дои:10.1038/46466. PMID 10586873. S2CID 205054671. Обсуждается в: Трэвис, Джон (2000). "Яйца мамы казнят митохондрии папы". Новости науки. 157 (1): 5. Дои:10.2307/4012086. JSTOR 4012086. Архивировано из оригинал 19 декабря 2007 г.
- ^ «Наем генеалогической компании по тестированию ДНК». Семейный поиск. Церковь Иисуса Христа Святых последних дней. 2016 г.. Получено 2 октября 2016.
- ^ Вила С., Саволайнен П., Мальдонадо Дж. Э., Аморим И. Р., Райс Дж. Э., Ханикатт Р. Л., Крэндалл К. А., Лундеберг Дж., Уэйн Р. К. (июнь 1997 г.). «Множественное и древнее происхождение домашней собаки». Наука. 276 (5319): 1687–9. Дои:10.1126 / science.276.5319.1687. PMID 9180076.
- ^ Вольф Дж. Н., Белый ди-джей, Вудхэмс М., Белый HE, Джеммелл Нью-Джерси (2011). «Сила и время возникновения митохондриального узкого места у лосося предполагает законсервированный механизм у позвоночных». PLOS ONE. 6 (5): e20522. Bibcode:2011PLoSO ... 620522W. Дои:10.1371 / journal.pone.0020522. ЧВК 3105079. PMID 21655224.
- ^ Кри Л.М., Сэмюэлс, округ Колумбия, де Соуза Лопес, СК, Раджасимха, Гонконг, Воннапинидж П., Манн Дж. Р., Даль Х. Х., Чиннери П. Ф. (февраль 2008 г.). «Уменьшение количества молекул митохондриальной ДНК во время эмбриогенеза объясняет быструю сегрегацию генотипов». Природа Генетика. 40 (2): 249–54. Дои:10,1038 / нг.2007,63. PMID 18223651. S2CID 205344980.
- ^ Цао Л., Ситара Х, Хории Т., Нагао Й, Имаи Х, Абе К., Хара Т., Хаяси Дж., Ёнекава Х. (март 2007 г.). «Узкое место в митохондриях происходит без снижения содержания мтДНК в половых клетках самок мышей». Природа Генетика. 39 (3): 386–90. Дои:10,1038 / нг1970. PMID 17293866. S2CID 10686347.
- ^ Вай Т., Теоли Д., Шубридж Е.А. (декабрь 2008 г.). «Генетическое« узкое место »митохондриальной ДНК является результатом репликации субпопуляции геномов». Природа Генетика. 40 (12): 1484–8. Дои:10,1038 / нг.258. PMID 19029901. S2CID 225349.
- ^ Александр М., Хо С.Ю., Молак М., Барнетт Р., Карлборг О., Дорсхорст Б., Хонакер С., Безье Ф., Уолберг П., Добни К., Сигель П., Андерссон Л., Ларсон Г. (октябрь 2015 г.). «Митогеномный анализ родословной цыплят 50 поколений показывает высокую скорость митохондриальной эволюции и доказательства отцовского наследования мтДНК». Письма о биологии. 11 (10): 20150561. Дои:10.1098 / rsbl.2015.0561. ЧВК 4650172. PMID 26510672.
- ^ Gyllensten U, Wharton D, Josefsson A, Wilson AC (июль 1991 г.). «Отцовское наследование митохондриальной ДНК у мышей». Природа. 352 (6332): 255–7. Bibcode:1991Натура.352..255G. Дои:10.1038 / 352255a0. PMID 1857422. S2CID 4278149.
- ^ Шитара Х., Хаяси Джи, Такахама С., Канеда Х., Ёнекава Х. (февраль 1998 г.). «Материнское наследование мышиной мтДНК у межвидовых гибридов: сегрегация просочившейся отцовской мтДНК с последующим предотвращением последующей отцовской утечки». Генетика. 148 (2): 851–7. ЧВК 1459812. PMID 9504930.
- ^ Чжао Х, Ли Н, Го В, Ху Х, Лю З., Гонг Дж, Ван А, Фэн Дж, Ву Ц (октябрь 2004 г.). «Дополнительные доказательства отцовской наследования митохондриальной ДНК у овец (Ovis aries)». Наследственность. 93 (4): 399–403. Дои:10.1038 / sj.hdy.6800516. PMID 15266295.
- ^ Steinborn R, Zakhartchenko V, Jelyazkov J, Klein D, Wolf E, Müller M, Brem G (апрель 1998 г.). «Состав родительской митохондриальной ДНК в клонированных эмбрионах крупного рогатого скота». Письма FEBS. 426 (3): 352–6. Дои:10.1016 / S0014-5793 (98) 00350-0. PMID 9600265.
- ^ Сингх А.Н. (апрель 2012 г.). «Расшифровка семейства A105: открытие отпечатков пальцев в масштабе всего генома для персонализированной геномной медицины». ScienceMED. 3 (2): 115–126.
- ^ Сингх А.Н. (май 2018 г.). «Индивидуальная биомедицинская информатика». BMC Аналитика больших данных. 3. Дои:10.1186 / s41044-018-0030-3.
- ^ Шварц М., Виссинг Дж. (Август 2002 г.). «Отцовское наследование митохондриальной ДНК». Медицинский журнал Новой Англии. 347 (8): 576–80. Дои:10.1056 / NEJMoa020350. PMID 12192017.
- ^ Луо С., Валенсия, Калифорния, Чжан Дж., Ли NC, Слоне Дж., Гуй Б., Ван Х, Ли З, Делл С., Браун Дж., Чен С. М., Чиен Й.Х., Хву В.Л., Фан-ПК, Вонг Л.Дж., Атвал П.С., Хуанг Т. (Декабрь 2018 г.). «Наследование митохондриальной ДНК у человека от двух родителей». Труды Национальной академии наук Соединенных Штатов Америки. 115 (51): 13039–13044. Дои:10.1073 / pnas.1810946115. ЧВК 6304937. PMID 30478036.
- ^ Пассамонти М, Гизелли Ф (февраль 2009 г.). «Двойное однопородное наследование: два митохондриальных генома, одна ценная модель для наследования и эволюции ДНК органелл». ДНК и клеточная биология. 28 (2): 79–89. Дои:10.1089 / dna.2008.0807. PMID 19196051.
- ^ Кондо Р., Мацуура Э. Т., Чигуса С. И. (апрель 1992 г.). «Дальнейшее наблюдение отцовской передачи митохондриальной ДНК дрозофилы методом селективной амплификации ПЦР». Генетические исследования. 59 (2): 81–4. Дои:10.1017 / S0016672300030287. PMID 1628820.
- ^ Вольф Дж. Н., Нафисиния М, Сутовский П., Баллард Дж. В. (январь 2013 г.). «Отцовская передача митохондриальной ДНК как неотъемлемая часть митохондриальной наследования в метапопуляциях Drosophila simulans». Наследственность. 110 (1): 57–62. Дои:10.1038 / hdy.2012.60. ЧВК 3522233. PMID 23010820.
- ^ Meusel MS, Moritz RF (декабрь 1993 г.). «Перенос отцовской митохондриальной ДНК при оплодотворении яиц медоносной пчелы (Apis mellifera L.)». Текущая генетика. 24 (6): 539–43. Дои:10.1007 / BF00351719. PMID 8299176. S2CID 15621371.
- ^ Фонтейн К.М., Кули-младший, Саймон С. (сентябрь 2007 г.). «Доказательства отцовской утечки у гибридных периодических цикад (Hemiptera: Magicicada spp.)». PLOS ONE. 2 (9): e892. Bibcode:2007PLoSO ... 2..892F. Дои:10.1371 / journal.pone.0000892. ЧВК 1963320. PMID 17849021.
- ^ Фрит М. (14 октября 2003 г.). «Запрет на попытки ученых создать троих детей». Независимый.
- ^ Робертс М. (27 сентября 2016 г.). «Первый ребенок из трех человек родился по новому методу». Новости BBC. Получено 28 сентября 2016.
- ^ а б Алексеев М.Ф. (октябрь 2009 г.). «Есть ли в старении что-то большее, чем митохондриальная ДНК и активные формы кислорода?». Журнал FEBS. 276 (20): 5768–87. Дои:10.1111 / j.1742-4658.2009.07269.x. ЧВК 3097520. PMID 19796285.
- ^ Энсон Р.М., Хадсон Э., Бор В.А. (февраль 2000 г.). «Эндогенное окислительное повреждение митохондрий было переоценено». Журнал FASEB. 14 (2): 355–60. Дои:10.1096 / fasebj.14.2.355. PMID 10657991.
- ^ Торслунд Т., Сунесен М., Бор В.А., Стевнснер Т. (апрель 2002 г.). «Ремонт 8-oxoG происходит медленнее в эндогенных ядерных генах, чем в митохондриальной ДНК, и без перекоса цепи». Ремонт ДНК. 1 (4): 261–73. Дои:10.1016 / S1568-7864 (02) 00003-4. PMID 12509245.
- ^ Гуляева Н.А., Кузнецова Е.А., Газиев А.И. (2006). «[Белки, связанные с митохондриальной ДНК, защищают ее от действия рентгеновских лучей и перекиси водорода]» [Белки, связанные с митохондриальной ДНК, защищают ее от действия рентгеновских лучей и перекиси водорода]. Биофизика (по-русски). 51 (4): 692–7. PMID 16909848.
- ^ Алексеев М., Шоколенко И., Уилсон Г., Леду С. (май 2013 г.). «Поддержание целостности митохондриальной ДНК - критический анализ и обновление». Перспективы Колд-Спринг-Харбор в биологии. 5 (5): a012641. Дои:10.1101 / cshperspect.a012641. ЧВК 3632056. PMID 23637283.
- ^ Хоган CM (2010). «Мутация». В Monosson E, Cleveland CJ (ред.). Энциклопедия Земли. Вашингтон, округ Колумбия: Национальный совет по науке и окружающей среде.
- ^ Алексеев М.Ф., Леду С.П., Уилсон Г.Л. (октябрь 2004 г.). «Митохондриальная ДНК и старение». Клиническая наука. 107 (4): 355–64. Дои:10.1042 / CS20040148. PMID 15279618. S2CID 5747202.
- ^ Burgstaller JP, Джонстон И.Г., Поултон Дж. (Январь 2015 г.). «Заболевания митохондриальной ДНК и влияние на развитие репродуктивных стратегий». Молекулярная репродукция человека. 21 (1): 11–22. Дои:10,1093 / моль / час / gau090. ЧВК 4275042. PMID 25425607.
- ^ Burgstaller JP, Джонстон И.Г., Джонс Н.С., Альбрехтова Дж., Кольбе Т., Фогл С., Футчик А., Майрхофер С., Кляйн Д., Сабитцер С., Блаттнер М., Гюлли С., Поултон Дж., Рюликке Т., Пиалек Дж., Штейнборн Р., Брем Г. (Июнь 2014 г.). «Сегрегация мтДНК в гетероплазматических тканях является обычным явлением in vivo и регулируется различиями гаплотипов и стадией развития». Отчеты по ячейкам. 7 (6): 2031–2041. Дои:10.1016 / j.celrep.2014.05.020. ЧВК 4570183. PMID 24910436.
- ^ а б Тейлор RW, Тернбулл DM (май 2005 г.). «Мутации митохондриальной ДНК при заболеваниях человека». Природа Обзоры Генетика. 6 (5): 389–402. Дои:10.1038 / nrg1606. ЧВК 1762815. PMID 15861210.
- ^ Анджелини С., Белло Л., Спинацци М., Феррати С. (июль 2009 г.). «Митохондриальные нарушения ядерного генома». Acta Myologica. 28 (1): 16–23. ЧВК 2859630. PMID 19772191.
- ^ Reguly B, Jakupciak JP, Parr RL (октябрь 2010 г.). «Делеция митохондриального генома размером 3,4 т.п.н. служит суррогатным прогностическим биомаркером рака простаты в гистопатологически доброкачественных ядрах биопсии». Журнал Канадской урологической ассоциации. 4 (5): E118-22. Дои:10.5489 / cuaj.932. ЧВК 2950771. PMID 20944788.
- ^ Робинсон К., Крид Дж., Регули Б., Пауэлл С., Витток Р., Кляйн Д., Маггра А., Клотц Л., Парр Р. Л., Дакубо Г. Д. (июнь 2010 г.). «Точное прогнозирование результатов повторной биопсии простаты с помощью анализа делеции митохондриальной ДНК». Рак предстательной железы и заболевания предстательной железы. 13 (2): 126–31. Дои:10.1038 / pcan.2009.64. PMID 20084081.
- ^ Майр, Р. (2019). «Измерение бесклеточной митохондриальной опухолевой ДНК улучшает обнаружение глиобластомы на моделях ортотопических ксенотрансплантатов, полученных от пациентов». Исследования рака. 79 (1): 220–230. Дои:10.1158 / 0008-5472.CAN-18-0074. ЧВК 6753020. PMID 30389699.
- ^ де Грей А (1999). Митохондриальная свободнорадикальная теория старения (PDF). ISBN 978-1-57059-564-6.[страница нужна ]
- ^ Льюис К.Н., Андзяк Б., Ян Т., Буффенштейн Р. (октябрь 2013 г.). «Реакция голого землекопа на окислительный стресс: смирись с этим». Антиоксиданты и редокс-сигналы. 19 (12): 1388–99. Дои:10.1089 / ars.2012.4911. ЧВК 3791056. PMID 23025341.
- ^ Шигенага М.К., Хаген TM, Эймс Б.Н. (ноябрь 1994 г.). «Окислительное повреждение и распад митохондрий при старении». Труды Национальной академии наук Соединенных Штатов Америки. 91 (23): 10771–8. Bibcode:1994PNAS ... 9110771S. Дои:10.1073 / пнас.91.23.10771. JSTOR 2365473. ЧВК 45108. PMID 7971961.
- ^ Трифунович А., Ханссон А., Вреденберг А., Ровио А. Т., Дюфур Е., Хворостов И., Спелбринк Дж. Н., Вибом Р., Якобс Х. Т., Ларссон Н. Г. (декабрь 2005 г.). «Соматические мутации мтДНК вызывают фенотипы старения, не влияя на продукцию активных форм кислорода». Труды Национальной академии наук Соединенных Штатов Америки. 102 (50): 17993–8. Bibcode:2005ПНАС..10217993Т. Дои:10.1073 / pnas.0508886102. JSTOR 4152716. ЧВК 1312403. PMID 16332961.
- ^ Аледо Дж. К., Ли И, де Магальяйнс Дж. П., Руис-Камачо М., Перес-Кларос Дж. А. (апрель 2011 г.). «Метионин, кодируемый в митохондриях, у млекопитающих обратно пропорционален продолжительности жизни». Ячейка старения. 10 (2): 198–207. Дои:10.1111 / j.1474-9726.2010.00657.x. PMID 21108730.
- ^ Ferrari CK (2004 г.). «Функциональные продукты, травы и нутрицевтики: к биохимическим механизмам здорового старения». Биогеронтология. 5 (5): 275–89. Дои:10.1007 / s10522-004-2566-z. PMID 15547316. S2CID 11568208.
- ^ Тейлор Р.В. (февраль 2005 г.). «Генная терапия для лечения нарушений митохондриальной ДНК». Мнение эксперта по биологической терапии. 5 (2): 183–94. Дои:10.1517/14712598.5.2.183. PMID 15757380. S2CID 35276183.
- ^ Белакович Г., Николова Д., Глууд С. (сентябрь 2013 г.). «Антиоксидантные добавки для предотвращения смертности». JAMA. 310 (11): 1178–9. Дои:10.1001 / jama.2013.277028. PMID 24045742.
- ^ Ван Дж., Сюн С., Се С., Марксбери В. Р., Ловелл М. А. (май 2005 г.). «Повышенное окислительное повреждение ядерной и митохондриальной ДНК при болезни Альцгеймера». Журнал нейрохимии. 93 (4): 953–62. Дои:10.1111 / j.1471-4159.2005.03053.x. PMID 15857398.
- ^ Бонда DJ, Ван Х, Ли Х. Г., Смит М. А., Перри Дж., Чжу Х (апрель 2014 г.). «Нейрональная недостаточность при болезни Альцгеймера: взгляд через зеркало окислительного стресса». Бюллетень неврологии. 30 (2): 243–52. Дои:10.1007 / с12264-013-1424-х. ЧВК 4097013. PMID 24733654.
- ^ Лю З., Чжоу Т., Зиглер А.С., Димитрион П., Цзо Л. (2017). «Окислительный стресс при нейродегенеративных заболеваниях: от молекулярных механизмов до клинического применения». Окислительная медицина и клеточное долголетие. 2017: 2525967. Дои:10.1155/2017/2525967. ЧВК 5529664. PMID 28785371.
- ^ Аяла-Пенья S (сентябрь 2013 г.). «Роль окислительного повреждения ДНК в митохондриальной дисфункции и патогенезе болезни Хантингтона». Свободная радикальная биология и медицина. 62: 102–110. Дои:10.1016 / j.freeradbiomed.2013.04.017. ЧВК 3722255. PMID 23602907.
- ^ Кикучи Х., Фурута А., Нисиока К., Сузуки С.О., Накабеппу Й., Иваки Т. (апрель 2002 г.). «Нарушение митохондриальных ферментов репарации ДНК против накопления 8-оксогуанина в моторных нейронах спинного мозга при боковом амиотрофическом склерозе». Acta Neuropathologica. 103 (4): 408–14. Дои:10.1007 / s00401-001-0480-х. PMID 11904761. S2CID 2102463.
- ^ Леманн Г, Будовский А, Мурадян К.К., Фрайфельд В.Е. (2006). «Анатомия митохондриального генома и видоспецифическая продолжительность жизни». Исследования омоложения. 9 (2): 223–6. Дои:10.1089 / rej.2006.9.223. PMID 16706648.
- ^ а б Леманн Г., Сегал Э., Мурадян К.К., Фрайфельд В.Е. (апрель 2008 г.). «Дополняют ли митохондриальная ДНК и скорость метаболизма друг друга в определении максимальной продолжительности жизни млекопитающих?». Исследования омоложения. 11 (2): 409–17. Дои:10.1089 / rej.2008.0676. PMID 18442324.
- ^ Леманн Г, Мурадян К.К., Фрайфельд В.Е. (2013). "Независимые от длины теломер и температуры тела детерминанты долголетия млекопитающих?". Границы генетики. 4 (111): 111. Дои:10.3389 / fgene.2013.00111. ЧВК 3680702. PMID 23781235.
- ^ Торен Д., Барзилай Т., Такуту Р., Леманн Г., Мурадиан К.К., Фрайфельд В.Е. (январь 2016 г.). «MitoAge: база данных для сравнительного анализа митохондриальной ДНК с особым акцентом на долголетие животных». Исследования нуклеиновых кислот. 44 (D1): D1262-5. Дои:10.1093 / нар / gkv1187. ЧВК 4702847. PMID 26590258.
- ^ Дамас Дж., Карнейро Дж., Гонсалвес Дж., Стюарт Дж. Б., Самуэльс, округ Колумбия, Аморим А., Перейра Ф. (сентябрь 2012 г.). «Делеции митохондриальной ДНК связаны с конформациями не-B ДНК». Исследования нуклеиновых кислот. 40 (16): 7606–21. Дои:10.1093 / нар / гкс500. ЧВК 3439893. PMID 22661583.
- ^ Оливейра PH, да Силва CL, Кабрал JM (2013). «Оценка нестабильности митохондриальной ДНК человека: новое понимание роли неканонических структур ДНК и мотивов последовательностей». PLOS ONE. 8 (3): e59907. Bibcode:2013PLoSO ... 859907O. Дои:10.1371 / journal.pone.0059907. ЧВК 3612095. PMID 23555828.
- ^ Браун В.М., Джордж М., Уилсон А.С. (апрель 1979 г.). «Быстрая эволюция митохондриальной ДНК животных». Труды Национальной академии наук Соединенных Штатов Америки. 76 (4): 1967–71. Bibcode:1979ПНАС ... 76.1967Б. Дои:10.1073 / пнас.76.4.1967. JSTOR 69636. ЧВК 383514. PMID 109836.
- ^ Дэвис, К. Лиланд (1998). «Митохондриальная ДНК: штат Теннесси против Пола Уэра» (PDF). Профили в ДНК. 1 (3): 6–7.
- ^ [1] Название судебного дела указано в апелляции.[требуется полная цитата ] Проверено 17 апреля 2015 года.
- ^ [2][самостоятельно опубликованный источник? ] Адвокат защиты. Проверено 17 апреля 2015 года.
- ^ Гарлицки, Дебби (11 марта 1998 г.). «Тесты ДНК получили больше жизни в тюрьме». Утренний звонок.
- ^ Пеллегрино, Питер; Томас, Питер; Медстар Телевидение; Телевизионная сеть зала суда (2000), Файлы судебной экспертизы. презираемая женщина Серия 55 Эпизод 55, [издатель не указан], OCLC 456260156
- ^ «Судья разрешает ДНК по делу Саманты Раннион», Associated Press, 18 февраля 2005 г. Проверено 4 апреля 2007 г.
- ^ «Собачья ДНК признана в деле об убийстве в Калифорнии», В архиве 2 февраля 2014 г. Wayback Machine Юридические новости Pit Bulletin, 5 декабря 2013 г. Дата обращения 21 января 2014 г.
- ^ Кеннеди, Маев (4 февраля 2013 г.). «Ричард III: ДНК подтверждает, что искривленные кости принадлежат королю». Хранитель. Получено 7 декабря 2014.
- ^ Сюй, X .; Арнасон, У. (1 мая 1996 г.). «Полная последовательность митохондриального генома западной низменной гориллы». Молекулярная биология и эволюция. 13 (5): 691–698. Дои:10.1093 / oxfordjournals.molbev.a025630. ISSN 0737-4038. PMID 8676744.
- ^ Nass MM, Nass S (декабрь 1963 г.). «ИНТРАМИТОХОНДРИАЛЬНЫЕ ВОЛОКНА С ХАРАКТЕРИСТИКАМИ ДНК: I. Реакции фиксации и электронного окрашивания». Журнал клеточной биологии. 19 (3): 593–611. Дои:10.1083 / jcb.19.3.593. ЧВК 2106331. PMID 14086138.
- ^ Schatz G, Haslbrunner E, Tuppy H (март 1964). «Дезоксирибонуклеиновая кислота, связанная с митохондриями дрожжей». Сообщения о биохимических и биофизических исследованиях. 15 (2): 127–32. Дои:10.1016 / 0006-291X (64) 90311-0. PMID 26410904.
- ^ Ehler E, Novotný J, Juras A, Chylenski M, Moravcík O, Paces J (январь 2019). «AmtDB: база данных древних митохондриальных геномов человека». Исследования нуклеиновых кислот. 47 (D1): D29 – D32. Дои:10.1093 / нар / gky843. ЧВК 6324066. PMID 30247677.
- ^ Гу З, Ли Дж, Гао С., Гун М., Ван Дж, Сюй Х, Чжан С., Ван Дж (июнь 2011 г.). «InterMitoBase: аннотированная база данных и платформа для анализа белок-белковых взаимодействий в митохондриях человека». BMC Genomics. 12: 335. Дои:10.1186/1471-2164-12-335. ЧВК 3142533. PMID 21718467.
- ^ Дамас Дж., Карнейро Дж., Аморим А., Перейра Ф. (январь 2014 г.). «MitoBreak: база данных точек разрыва митохондриальной ДНК». Исследования нуклеиновых кислот. 42 (Проблема с базой данных): D1261-8. Дои:10.1093 / nar / gkt982. ЧВК 3965124. PMID 24170808.
- ^ Ивасаки В., Фукунага Т., Исагозава Р., Ямада К., Маэда Ю., Сато Т.П., Садо Т., Мабучи К., Такешима Х., Мия М., Нисида М. (ноябрь 2013 г.). «MitoFish и MitoAnnotator: база данных митохондриального генома рыб с точным и автоматическим конвейером аннотации». Молекулярная биология и эволюция. 30 (11): 2531–40. Дои:10.1093 / molbev / mst141. ЧВК 3808866. PMID 23955518.
- ^ Cawthorn DM, Steinman HA, Witthuhn RC (ноябрь 2011 г.). «Создание базы данных последовательностей митохондриальной ДНК для идентификации видов рыб, коммерчески доступных в Южной Африке». Ресурсы по молекулярной экологии. 11 (6): 979–91. Дои:10.1111 / j.1755-0998.2011.03039.x. PMID 21689383.
- ^ Ли Ю.С., О Дж, Ким Ю, Ким Н, Ян С., Хван Ю.В. (январь 2008 г.). «Mitome: динамическая и интерактивная база данных для сравнительной митохондриальной геномики у многоклеточных животных». Исследования нуклеиновых кислот. 36 (Проблема с базой данных): D938-42. Дои:10.1093 / нар / гкм763. ЧВК 2238945. PMID 17940090.
- ^ Каталано Д., Личчулли Ф., Тури А., Грилло Дж., Сакконе С., Д'Элия Д. (январь 2006 г.). «MitoRes: ресурс ядерно-кодируемых митохондриальных генов и их продуктов в Metazoa». BMC Bioinformatics. 7: 36. Дои:10.1186/1471-2105-7-36. ЧВК 1395343. PMID 16433928.
- ^ Кумар М., Капил А., Шанкер А. (ноябрь 2014 г.). "MitoSatPlant: база данных митохондриальных микросателлитов viridiplantae". Митохондрия. 19 Pt B: 334–7. Дои:10.1016 / j.mito.2014.02.002. PMID 24561221.
- ^ Д'Онорио де Мео П., Д'Антонио М., Григио Ф., Лупи Р., Борсани М., Павеси Дж., Кастриньяно Т., Песоле Дж., Гисси С. (январь 2012 г.). «MitoZoa 2.0: ресурс базы данных и поисковые инструменты для сравнительного и эволюционного анализа митохондриальных геномов Metazoa». Исследования нуклеиновых кислот. 40 (Проблема с базой данных): D1168-72. Дои:10.1093 / нар / gkr1144. ЧВК 3245153. PMID 22123747.
внешние ссылки
 СМИ, связанные с Митохондриальная ДНК в Wikimedia Commons
СМИ, связанные с Митохондриальная ДНК в Wikimedia Commons
