Неврология сна - Neuroscience of sleep

В нейробиология сна это исследование нейробиология и физиологический основа характера спать и его функции. Традиционно сон изучается как часть психология и лекарство.[1] Изучение сна с точки зрения нейробиологии приобрело известность с развитием технологий и распространением исследований в области нейробиологии во второй половине двадцатого века.
Важность сна подтверждается тем фактом, что организмы ежедневно проводят часы своего времени во сне, и что недосыпание может иметь катастрофические последствия, в конечном итоге ведущие к смерти.[2][3] Для столь важного явления цели и механизмы сна поняты лишь частично, настолько, что совсем недавно, в конце 1990-х гг.[4] его пошутили: «Единственная известная функция сна - это излечивать сонливость».[5] Однако разработка улучшенных методов визуализации, таких как ЭЭГ, ДОМАШНИЙ ПИТОМЕЦ и фМРТ, наряду с высокой вычислительной мощностью, привели к все большему пониманию механизмов, лежащих в основе сна.
Основные вопросы нейробиологического исследования сна:
- Каковы корреляты сна, то есть каков минимальный набор событий, которые могут подтвердить, что организм спит?
- Как сон запускается и регулируется мозг и нервная система ?
- Что происходит в мозгу во время сна?
- Как мы можем понять функцию сна на основе физиологических изменений в мозге?
- Что вызывает различные нарушения сна и как их лечить?[6]
Другие области современных нейробиологических исследований сна включают эволюция сна, сна во время разработка и старение, сон животных, механизм действия препаратов на сон, сны и кошмары, а также стадии возбуждение между сном и бодрствованием.[7]
Вступление
Сон с быстрым движением глаз (REM), сон с небыстрым движением глаз (NREM или non-REM) и бодрствование представляют три основных режима сознания, нейронной активности и физиологической регуляции.[8] Сам NREM-сон разделен на несколько этапов - N1, N2 и N3. Сон продолжается 90-минутными циклами REM и NREM, обычно в следующем порядке: N1 → N2 → N3 → N2 → REM. Когда люди засыпают, активность тела замедляется. Температура тела, частота сердечных сокращений, частота дыхания и потребление энергии снижаются. Мозговые волны становятся все медленнее и больше. Возбуждающий нейромедиатор ацетилхолин становится менее доступным в мозгу.[9] Люди часто маневрируют, чтобы создать благоприятную для тепла среду, например, свернувшись калачиком в холодную погоду. Рефлексы остаются достаточно активными.
Быстрый сон считается более близким к бодрствованию и характеризуется быстрым движением глаз и атонией мышц. NREM считается глубоким сном (самая глубокая часть NREM называется медленный сон ) и характеризуется отсутствием заметных движений глаз или параличом мышц. Во время сна мозг потребляет значительно меньше энергии, особенно во время сна, отличного от быстрого сна, чем во время бодрствования. В областях со сниженной активностью мозг восстанавливает запасы аденозинтрифосфат (АТФ), молекула, используемая для кратковременного хранения и транспортировки энергии.[10] (Поскольку при спокойном бодрствовании мозг отвечает за 20% энергии, потребляемой телом, это сокращение оказывает независимо заметное влияние на общее потребление энергии.)[11] Во время медленноволнового сна люди выделяют всплески гормон роста. Весь сон, даже днем, связан с секрецией пролактин.[12]
По данным Hobson & McCarley гипотеза активации-синтеза предложенный в 1975–1977 гг., чередование быстрых и не-быстрых состояний можно объяснить циклическими, взаимно влияющими системами нейротрансмиттеров.[13] Время сна контролируется циркадные часы, а у людей, в некоторой степени, волевым поведением. Термин циркадный происходит от латинского около, что означает «около» (или «приблизительно»), и Diem или умирает, что означает «день». Циркадные часы относятся к биологическому механизму, который управляет множеством биологических процессов, заставляя их проявлять эндогенные, увлекаемые колебания продолжительностью около 24 часов. Эти ритмы широко наблюдались у растений, животных, грибов и цианобактерий.
Корреляты сна
Одним из важных вопросов исследования сна является четкое определение состояния сна. Эта проблема возникает из-за того, что сон традиционно определялся как состояние сознание а не как физиологическое состояние,[14][15] таким образом, не было четкого определения того, какой минимальный набор событий составляет сон, и отличить его от других состояний частичного или полного отсутствия сознания. Проблема составления такого определения сложна, поскольку оно должно включать в себя множество режимов сна, встречающихся у разных видов.
На симптоматическом уровне сон характеризуется отсутствием реактивности на сенсорный входы, низкие мотор выход, ослабленное сознание осведомленность и быстрая обратимость к бодрствование.[16] Однако перевести их в биологическое определение сложно, потому что ни один из путей в головном мозге не отвечает за генерацию и регуляцию сна. Одно из самых ранних предложений состояло в том, чтобы определить сон как отключение кора головного мозга и таламус[17] из-за почти полного отсутствия реакции на сенсорные сигналы во время сна. Однако это было признано недействительным, поскольку обе области активны в некоторых фазах сна. Фактически, похоже, что таламус деактивирован только в смысле передачи сенсорной информации в кору.[18]
Некоторые из других наблюдений за сном включали уменьшение симпатическая активность и увеличение парасимпатическая активность в медленном сне, а также учащение пульса и артериального давления, сопровождающееся снижением гомеостатический ответ и мышечный тонус в течение Быстрый сон.[19][20] Однако эти симптомы не ограничиваются ситуациями сна и не соответствуют конкретным физиологическим определениям.
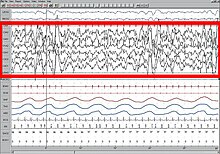
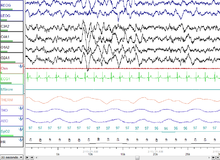
Совсем недавно проблема определения была решена путем наблюдения за общей мозговой активностью в виде характерных паттернов ЭЭГ.[21] Каждый стадия сна и бодрствование имеет характерный образец ЭЭГ который можно использовать для определения стадии сна. Бодрствование обычно характеризуется бета (12–30 Гц) и гамма (25–100 Гц) в зависимости от того, была ли активность мирная или стрессовая.[22] Начало сна связано с замедлением этой частоты до сонливости. альфа (8–12 Гц) и, наконец, до тета (4–10 Гц) фазы 1 медленного сна.[23] Эта частота далее постепенно уменьшается на более высоких стадиях медленного и быстрого сна. С другой стороны, амплитуда волн сна самая низкая во время бодрствования (10–30 мкВ) и постепенно увеличивается на разных стадиях сна. Этап 2 характеризуется шпиндели сна (прерывистые группы волн на сигма-частоте, т. е. 12–14 Гц) и К комплексы (резкое отклонение вверх с последующим более медленным отклонением вниз). У сна стадии 3 больше шпинделей сна.[24][25][26] Стадии 3 и 4 имеют очень большую амплитуду. дельта-волны (0–4 Гц) и известны как медленный сон.[27] Быстрый сон характеризуется низкой амплитудой волн смешанной частоты. Часто присутствует пилообразная волна.[28]
Онтогенез и филогения сна

Вопросы о том, как сон развился в царстве животных и как он развился у людей, особенно важны, потому что они могут дать ключ к разгадке функций и механизмов сна соответственно.
Эволюция сна
На эволюцию различных типов сна влияет ряд факторов. селективное давление, включая размер тела, относительную скорость метаболизма, хищничество, тип и расположение источников пищи и иммунную функцию.[29][30][31][32] Сон (особенно глубокий SWS и REM ) - сложное поведение, потому что оно резко увеличивается хищничество риск. Это означает, что для того, чтобы сон развился, функции сна должны были иметь существенное преимущество перед риском, который он влечет за собой. Фактически, изучение сна у разных организмов показывает, как они сбалансировали этот риск за счет развития частичных механизмов сна или создания защитных сред обитания. Таким образом, изучение эволюции сна может дать ключ не только к аспектам и механизмам развития, но и к пониманию адаптивный оправдание сна.
Одна из проблем при изучении эволюции сна заключается в том, что адекватная информация о сне известна только для двух типов животных: хордовые и членистоногие.[7] На основании имеющихся данных были использованы сравнительные исследования, чтобы определить, как мог развиваться сон. Один вопрос, на который ученые пытаются ответить с помощью этих исследований, заключается в том, развивался ли сон только один или несколько раз. Чтобы понять это, они смотрят на режимы сна у разных классов животных, эволюционная история которых довольно хорошо известна, и изучают их сходства и различия.
У людей есть и медленный, и быстрый сон, в обеих фазах оба глаза закрыты и оба полушария вовлеченного мозга. Сон также был зарегистрирован в млекопитающие кроме людей. Одно исследование показало, что ехидны обладают только медленным сном (не-REM). Это, по-видимому, указывает на то, что быстрый сон появился в эволюции только после терианцы.[33] Но позже это было оспорено исследованиями, которые утверждали, что сон у ехидны объединяет оба режима в одно состояние сна.[34] Другие исследования показали особую форму сна в зубастые (подобно дельфины и морские свиньи ). Это называется однополушарный медленный сон (USWS). В любое время во время этого режима сна ЭЭГ одного полушария мозга указывает на сон, в то время как другое - на бодрствование. В некоторых случаях соответствующий глаз открыт. Это может позволить животному снизить риск хищников и снизить риск сна во время плавания в воде, хотя животное также может спать в состоянии покоя.[35][36]
Найденные у млекопитающих корреляты сна действительны для птицы также, то есть птичий сон очень похож на сон млекопитающих и включает в себя как быстрый, так и быстрый сон с похожими характеристиками, включая закрытие обоих глаз, снижение мышечного тонуса и т. д.[37] Однако доля быстрого сна у птиц намного ниже. Кроме того, некоторые птицы могут спать с одним открытым глазом, если в окружающей среде существует высокий риск нападения хищников.[38][39] Это дает возможность спать в полете; Учитывая, что сон очень важен, а некоторые виды птиц могут летать неделями непрерывно, это кажется очевидным результатом. Однако сон в полете не зарегистрирован и пока не подтверждается данными ЭЭГ. Дальнейшие исследования могут объяснить, спят ли птицы во время полета, или существуют другие механизмы, обеспечивающие их здоровье во время длительных перелетов без сна.
В отличие от птиц, среди рептилия разновидность. Единственное распространенное наблюдение - рептилии не спят в фазе быстрого сна.[7]
Спать в некоторых беспозвоночные также широко изучается, например, сон в плодовые мухи (Drosophila)[40] и пчелы.[41] Некоторые механизмы сна у этих животных были обнаружены, в то время как другие остаются неясными. Признаки, определяющие сон, по большей части были идентифицированы, и, как и у млекопитающих, это включает снижение реакции на сенсорный ввод, отсутствие двигательной реакции в виде усик неподвижность и др.
Тот факт, что обе формы сна встречаются у млекопитающих и птиц, но не у рептилий (которые считаются промежуточной стадией), указывает на то, что сон мог развиваться отдельно у обоих. За подтверждением этого могут последовать дальнейшие исследования относительно того, участвуют ли корреляты ЭЭГ сна в его функциях или они являются просто характеристикой. Это может еще больше помочь в понимании роли сна в долгосрочной пластичности.
Согласно Tsoukalas (2012), быстрый сон - это эволюционная трансформация хорошо известного защитного механизма, тоническая неподвижность рефлекс. Этот рефлекс, также известный как гипноз животных или симулирование смерти, функционирует как последняя линия защиты от атакующего хищника и состоит из полного обездвиживания животного: животное кажется мертвым (ср. «Играющий опоссум»). Нейрофизиология и феноменология этой реакции демонстрируют поразительное сходство с быстрым сном, факт, который свидетельствует о глубоком эволюционном родстве. Например, обе реакции демонстрируют контроль ствола мозга, паралич, активацию симпатической нервной системы и изменения терморегуляции. Эта теория объединяет многие более ранние открытия в единую и хорошо информированную с точки зрения эволюции структуру.[42][43]
Развитие сна и старение
Онтогенез сна - это изучение сна у разных возрастных групп вида, особенно во время разработка и старение. Среди млекопитающих дольше всего спят младенцы.[44] У человеческих младенцев в среднем 8 часов быстрого сна и 8 часов медленного сна. Процент времени, затрачиваемого на каждый режим сна, сильно варьируется в первые несколько недель развития, и некоторые исследования коррелируют это со степенью раннего развития ребенка.[45] В течение нескольких месяцев постнатального развития наблюдается заметное сокращение количества часов, проводимых в фазе быстрого сна. К тому времени, когда ребенок становится взрослым, он проводит около 6-7 часов в медленном сне и только около часа в фазе быстрого сна.[46][47] Это верно не только для людей, но и для многих животных, питающихся от родителей.[48] Наблюдение за тем, что процент быстрого сна очень высок на первых стадиях развития, привело к гипотезе о том, что быстрый сон может способствовать раннему развитию мозга.[45] Однако эта теория была опровергнута другими исследованиями.
Во время сна поведение сна претерпевает существенные изменения. юность. Некоторые из этих изменений могут быть общественными у людей, но другие изменения носят гормональный характер. Еще одно важное изменение - уменьшение количества часов сна по сравнению с детством, которое постепенно становится идентичным взрослому. Также предполагается, что гомеостатическая регуляция механизмы могут быть изменены в подростковом возрасте. Помимо этого, еще предстоит изучить влияние изменения распорядка подростков на другое поведение, такое как познание и внимание.[49][50] Охайон и др., Например, заявили, что сокращение общего времени сна с детства до подросткового возраста, по-видимому, больше связано с факторами окружающей среды, чем с биологическими особенностями.[51]
В зрелом возрасте архитектура сна показывает, что латентность сна и время, проведенное на стадиях 1 и 2 NREM, могут увеличиваться с возрастом, в то время как время, проведенное в REM и SWS-сне, кажется, уменьшается.[51] Эти изменения часто связаны с атрофией мозга, когнитивными нарушениями и нейродегенеративными расстройствами в пожилом возрасте.[51][52][53][54][55][56] Например, Backhaus et al указали, что снижение декларативной консолидации памяти в среднем возрасте (в их эксперименте: от 48 до 55 лет) происходит из-за меньшего количества SWS, которое уже может начать уменьшаться в возрасте около 30 лет. .[52] Согласно Мандеру и соавторам, атрофия серого вещества медиальной префронтальной коры (mPFC) является предиктором нарушения медленной активности во время медленного сна, что может ухудшить консолидацию памяти у пожилых людей.[53] И нарушения сна, такие как чрезмерная сонливость днем и ночью бессонница, часто называют фактором риска прогрессирующего функционального нарушения у Болезнь Альцгеймера (AD) или болезнь Паркинсона (PD).[54][56]
Поэтому сон при старении - еще одна не менее важная область исследований. Распространенным наблюдением является то, что многие пожилые люди проводят время в постели после начала сна из-за неспособности заснуть и испытывают заметное снижение эффективности сна.[57] Также могут быть некоторые изменения в циркадные ритмы.[58] Продолжаются исследования того, что вызывает эти изменения и как их можно уменьшить, чтобы обеспечить комфортный сон пожилых людей.
Активность мозга во время сна


Понимание активности различных частей мозга во время сна может дать ключ к пониманию функций сна. Было замечено, что умственная активность присутствует на всех стадиях сна, хотя и из разных областей мозга. Итак, вопреки распространенному мнению, мозг никогда полностью не отключается во время сна. Кроме того, интенсивность сна в конкретном регионе гомеостатически связано с соответствующим количеством активности перед сном.[59][60] Использование таких методов визуализации, как ПЭТ и фМРТ, в сочетании с записями ЭЭГ, дает представление о том, какие области мозга участвуют в создании характерных волновых сигналов и каковы их функции.
Историческое развитие поэтапной модели
Стадии сна впервые были описаны в 1937 г. Альфред Ли Лумис и его коллеги, которые разделяли разные электроэнцефалография (ЭЭГ) характеристики сна на пяти уровнях (от A до E), представляющие спектр от бодрствования до глубокого сна.[61] В 1953 году был открыт быстрый сон как отдельный вид сна, и поэтому Уильям К. Демент и Натаниэль Клейтман переклассифицирован сон на четыре стадии медленной фазы сна и фазы быстрого сна.[21] Критерии постановки были стандартизированы в 1968 г. Аллан Рехтшаффен и Энтони Кейлс в «Руководстве по оценке сна R&K».[62][63]
В стандарте R&K NREM-сон разделен на четыре стадии, при этом медленноволновой сон включает стадии 3 и 4. На стадии 3 дельта-волны составляли менее 50% всех волновых паттернов, в то время как они составляли более 50%. на стадии 4. Более того, REM-сон иногда упоминается как стадия 5. В 2004 году AASM поручил целевой группе AASM Visual Scoring Task Force пересмотреть систему оценки R&K. Обзор привел к нескольким изменениям, наиболее значительным из которых является объединение этапов 3 и 4 в этап N3. Пересмотренная оценка была опубликована в 2007 году как Руководство AASM по оценке сна и связанных с ним событий.[64] Также были добавлены пробуждения, респираторные, сердечные и двигательные события.[65][66]
Активность медленного сна
NREM сон характеризуется снижением глобального и регионального мозговой кровоток. Он составляет около 80% всего сна у взрослых людей.[67] Изначально ожидалось, что мозговой ствол, который был связан с возбуждением, будет неактивным, но позже выяснилось, что это было связано с низким разрешением исследований ПЭТ, и было показано, что в стволе мозга также присутствует некоторая медленная волновая активность. Однако другие части мозга, включая предклинье, базальный передний мозг и базальный ганглий отключаются во время сна. Многие области коры также неактивны, но на разных уровнях. Например, вентромедиальная префронтальная кора считается наименее активной зоной, а первичная кора, наименее деактивированный.[25][68]
NREM-сон характеризуется медленными колебаниями, шпиндели и дельта-волны. Было показано, что медленные колебания исходят от коры головного мозга, поскольку поражения в других частях мозга не влияют на них, а поражения в коре влияют.[69] Было показано, что дельта-волны генерируются взаимно связанными таламическими и корковыми нервными цепями. Во время сна таламус перестает передавать сенсорную информацию в мозг, однако он продолжает производить сигналы, которые отправляются в его корковые проекции. Эти волны генерируются в таламусе даже в отсутствие коры, но кортикальный выход, по-видимому, играет роль в одновременном возбуждении больших групп нейронов.[70] В ретикулярное ядро таламуса считается кардиостимулятором шпинделей сна. Это дополнительно подтверждается тем фактом, что ритмическая стимуляция таламуса приводит к увеличению вторичного деполяризация в корковых нейронах, что дополнительно приводит к увеличению амплитуды возбуждения, вызывая самостоятельную активность. Было предсказано, что веретена сна играют роль в отключении коры головного мозга от сенсорных входов и обеспечении проникновения ионов кальция в клетки, таким образом потенциально играя роль в Пластичность.[71][72]
NREM 1
NREM Этап 1 (N1 - легкий сон, сонливость, сонный сон - 5–10% от общего количества сна у взрослых): это стадия сна, которая обычно возникает между сном и бодрствованием, а иногда и между периодами более глубокого сна и периодами быстрого сна. Мышцы активны, глаза медленно вращаются, умеренно открываются и закрываются. Мозг переходит от альфа-волны с частотой 8–13Гц (часто бывает в состоянии бодрствования) до тета-волны имеющий частоту 4–7 Гц. Внезапные подергивания и гипнотические придурки, также известный как положительный миоклонус, может быть связано с наступлением сна во время N1. Некоторые люди также могут испытывать гипнагогические галлюцинации на этом этапе. Во время Non-REM1 люди теряют часть мышечный тонус и наиболее осознанное понимание внешней среды.
NREM 2
NREM, стадия 2 (N2 - 45–55% общего сна у взрослых[73]): На этом этапе тета-активность наблюдается, и спящих постепенно становится труднее разбудить; то альфа-волны предыдущего этапа прерываются резкой активностью, называемой шпиндели сна (или таламокортикальные веретена) и К-комплексы.[74] Шпиндели сна находятся в диапазоне от 11 до 16 Гц (чаще всего 12–14 Гц). На этом этапе мышечная активность, измеренная с помощью ЭМГ, уменьшается, и сознательное понимание внешней среды исчезает.
NREM 3
NREM Стадия 3 (N3 - 15–25% от общего количества сна у взрослых): Эта стадия, ранее разделенная на 3 и 4 стадии, называется медленный сон (SWS) или глубокий сон. SWS инициируется в преоптическая область и состоит из дельта-активность, волны высокой амплитуды с частотой менее 3,5 Гц. Спящий менее восприимчив к окружающей среде; многие раздражители окружающей среды больше не вызывают никаких реакций. Считается, что медленноволновой сон является наиболее успокаивающей формой сна, фазой, которая больше всего снимает субъективное ощущение сонливости и восстанавливает тело.[75]
Для этого этапа характерно наличие не менее 20% дельта-волны диапазон 0,5–2 Гц и размах амплитуды> 75 мкВ. (Стандарты ЭЭГ определяют дельта-волны от 0 до 4 Гц, но стандарты сна как в исходной модели R&K (Аллан Рехтшаффен и Энтони Кейлс в «Руководстве по оценке сна R&K»),[62][63] а также в новых рекомендациях AASM 2007 года диапазон составляет 0,5–2 Гц.) Это стадия, на которой парасомнии, такие как ночные кошмары, ночной энурез, лунатизм, и сомнилокв происходить. Многие иллюстрации и описания все еще показывают стадию N3 с дельта-волнами 20–50% и стадию N4 с дельта-волнами более 50%; они были объединены в этап N3.[73]
Активность быстрого сна

REM-стадия (REM-сон - 20-25% от общего времени сна у взрослых[76]): Во время быстрого сна большинство мышц парализовано, а частота сердечных сокращений, дыхание и температура тела становятся нерегулируемыми. Быстрый сон включается ацетилхолин секреция и ингибируется нейронами, которые секретируют моноамины, включая серотонин. REM также называют парадоксальный сон потому что спящего, хотя и демонстрируют высокочастотные волны ЭЭГ, похожие на состояние бодрствования, разбудить труднее, чем на любой другой стадии сна.[74] Жизненные показатели указывают на то, что мозг возбужден, а потребление кислорода выше, чем когда спящий бодрствует.[77] Быстрый сон характеризуется высоким общим церебральным кровотоком, сопоставимым с бодрствованием.[78] Фактически, во многих областях коры головного мозга было зарегистрировано больше кровотока во время быстрого сна, чем даже во время бодрствования - это включает в себя гиппокамп, временный -затылочный области, некоторые части коры и базальный передний мозг. В лимбический и паралимбическая система, включая миндалина другие активные области во время быстрого сна.[78][79] Хотя активность мозга во время быстрого сна кажется очень похожим на бодрствование, основное различие между быстрым сном и бодрствованием заключается в том, что возбуждение в REM более эффективно подавляется. Это вместе с виртуальной тишиной моноаминергический можно сказать, что нейроны головного мозга характеризуют REM.[80]
Новорожденный ребенок проводит 8–9 часов в день только в фазе быстрого сна. К пяти годам в фазе быстрого сна проводят лишь немногим более двух часов.[81] Функция быстрого сна неопределенная, но его отсутствие ухудшает способность усваивать сложные задачи. Функциональный паралич со стороны мышечной атония в фазе быстрого сна может быть необходимо для защиты организмов от самоповреждений путем физического отыгрывания сцен из часто ярких снов, которые происходят на этой стадии.
В записях ЭЭГ быстрый сон характеризуется высокой частотой, низкой амплитудой активности и спонтанным возникновением бета и гамма волны. Лучшими кандидатами для генерации этих быстрых частотных волн являются быстрые ритмичные взрывающиеся нейроны в кортикоталамических цепях. В отличие от медленного сна, ритмы быстрой частоты синхронизируются в ограниченных областях в определенных локальных цепях между таламокортикальными и неокортикальными областями. Говорят, что они генерируются холинергический процессы из структур ствола мозга.
Помимо этого, миндалевидное тело играет роль в модуляции быстрого сна, подтверждая гипотезу о том, что быстрый сон позволяет обрабатывать внутреннюю информацию. Высокая активность миндалины также может вызывать эмоциональные реакции во сне.[82] Точно так же причудливость снов может быть связана с пониженной активностью префронтальный регионы, которые участвуют в интеграции информации, а также эпизодическая память.
Понто-геникуло-затылочные волны
Быстрый сон также связан с возбуждением понто-геникуло-затылочный волны (также называемые фазовой активностью или волнами PGO) и активность в холинергической восходящей системе возбуждения. Волны PGO были зарегистрированы в латеральное коленчатое ядро и затылочная кора в период до быстрого сна и, как полагают, представляют содержание сновидений. Более высокое отношение сигнал / шум в кортикальном канале LG предполагает, что визуальные образы во сне могут появляться до полного развития фазы быстрого сна, но это еще не подтверждено. Волны PGO могут также играть роль в развитии и структурном созревании мозга, а также долгосрочное потенцирование у неполовозрелых животных на основании того факта, что во время сна в развивающемся мозгу наблюдается высокая активность PGO.[83][84]
Повторная активация сети
Другая форма активности во время сна - реактивация. Некоторые электрофизиологические исследования показали, что паттерны нейрональной активности, обнаруженные во время учебного задания перед сном, реактивируются в мозгу во время сна.[85] Это, наряду с совпадением активных областей с областями, отвечающими за память, привело к теории, что сон может иметь некоторые функции консолидации памяти. В связи с этим некоторые исследования показали, что после последовательной двигательной задачи предмоторная и зрительная кора вовлеченные области наиболее активны во время быстрого сна, но не во время медленного сна. Точно так же гиппокамп области, участвующие в задачах пространственного обучения, реактивируются во время медленного сна, но не во время быстрого сна. Такие исследования предполагают роль сна в консолидации определенных типов памяти. Однако до сих пор неясно, консолидируются ли этими механизмами и другие типы памяти.[86]
Неокортикальный диалог гиппокампа
Неокортикальный диалог гиппокампа относится к очень структурированным взаимодействиям во время SWS между группами нейронов, называемыми ансамблями в гиппокамп и неокортекс.[87][88] Острые волновые паттерны (SPW) доминируют в гиппокампе во время SWS, и популяции нейронов в гиппокампе участвуют в организованных всплесках во время этой фазы. Это выполняется синхронно с изменениями состояния коры (состояние ВНИЗ / ВВЕРХ) и координируется медленными колебаниями в коре. Эти наблюдения в сочетании со знанием того, что гиппокамп играет роль в краткосрочной и среднесрочной памяти, тогда как кора головного мозга играет роль в долговременной памяти, привели к гипотезе о том, что неокортикальный диалог гиппокампа может быть механизмом, через который гиппокамп передает информацию. к коре. Таким образом, говорят, что неокортикальный диалог гиппокампа играет роль в консолидации памяти.[89]
Регулирование сна
Регулирование сна относится к контролю перехода организма между сном и бодрствованием.[90] Ключевые вопросы здесь - определить, какие части мозга участвуют в наступлении сна и каковы их механизмы действия.[91] У людей и большинства животных сон и бодрствование, кажется, следуют электронному резкий поворот модель, то есть оба состояния стабильны, а промежуточные - нет.[92][93] Конечно, в отличие от триггера, в случае сна кажется, что таймер отсчитывает минуту пробуждения, так что по истечении определенного периода времени нужно спать, и в таком случае даже бодрствование становится нестабильным состоянием. . Обратное также может быть верным в меньшей степени.
Начало сна
Некоторый свет на механизмы наступления сна было пролито открытием, что поражения в преоптическая область и передний гипоталамус привести к бессонница в то время как в заднем гипоталамусе вызывают сонливость.[94][95] Это было дополнительно сужено, чтобы показать, что центральная покрышка среднего мозга это область, которая играет роль в активации коры. Таким образом, начало сна, по-видимому, возникает в результате активации переднего гипоталамуса наряду с торможением задних отделов и центральной покровной части среднего мозга. Дальнейшие исследования показали, что гипоталамическая область называется вентролатеральное преоптическое ядро производит тормозной нейротрансмиттер ГАМК который подавляет систему возбуждения во время сна.[92]
Модели регуляции сна
Сон регулируется двумя параллельными механизмами, гомеостатическая регуляция и циркадная регуляция, контролируемый гипоталамусом и супрахиазматическое ядро (SCN), соответственно. Хотя точная природа влечения ко сну неизвестна, гомеостатическое давление нарастает во время бодрствования, и это продолжается до тех пор, пока человек не засыпает. Аденозин считается, что играет решающую роль в этом, и многие люди предположили, что повышение давления частично связано с накоплением аденозина. Однако некоторые исследователи показали, что одно только накопление не может полностью объяснить это явление. Циркадный ритм - это 24-часовой цикл в организме, который, как было показано, продолжается даже при отсутствии внешних сигналов. Это вызвано проекциями от SCN к стволу мозга.
Эта модель двух процессов была впервые предложена в 1982 г. Борбели,[96] которые назвали их Процессом S (гомеостатический) и Процессом C (Циркадный) соответственно. Он показал, как плотность медленных волн увеличивается в течение ночи, а затем уменьшается в начале дня, в то время как циркадный ритм похож на синусоиду. Он предположил, что давление на сон было максимальным, когда разница между ними была наибольшей.
В 1993 году появилась другая модель, названная моделью процесса оппонента.[97] было предложено. Эта модель объясняет, что эти два процесса противостоят друг другу, чтобы вызвать сон, в отличие от модели Борбели. Согласно этой модели, SCN, который участвует в циркадном ритме, усиливает бодрствование и противодействует гомеостатическому ритму. В противоположность этому гомеостатический ритм, регулируемый сложным мультисинаптическим путем в гипоталамусе, который действует как переключатель и отключает систему возбуждения. Оба эффекта вместе производят эффект сна и бодрствования, похожий на качели.[80] Совсем недавно было высказано предположение, что обе модели имеют некоторую ценность для них, в то время как новые теории утверждают, что ингибирование медленного сна с помощью быстрого сна также может играть роль.[98] В любом случае, механизм двух процессов добавляет гибкости простому циркадному ритму и мог развиться как адаптивная мера.
Таламическая регуляция
Большая часть мозговой активности во сне связана с таламус и похоже, что таламус может играть решающую роль в SWS. Два первичных колебания в медленный сон, дельта и медленное колебание, могут генерироваться как таламусом, так и корой. Однако веретена сна могут быть созданы только таламусом, поэтому его роль очень важна. Гипотеза таламического водителя ритма[99] Считает, что эти колебания генерируются таламусом, но синхронизация нескольких групп таламических нейронов, активируемых одновременно, зависит от взаимодействия таламуса с кора. Таламус также играет важную роль в наступлении сна, когда он переходит из тонического режима в фазический, таким образом действуя как зеркало как для центральных, так и для децентрализованных элементов и связывая удаленные части коры для координации их активности.[100][101][102]
Восходящая ретикулярная активирующая система
В восходящая ретикулярная активирующая система состоит из набора нейронных подсистем, которые проецируются из различных таламический ядер и ряд дофаминергический, норадренергический, серотонинергический, гистаминергический, холинергический, и глутаматергический ядра мозга.[103][104][105][106] В бодрствующем состоянии он получает всевозможную неспецифическую сенсорную информацию и передает ее в кору. Он также модулирует реакцию борьбы или бегства и, следовательно, связан с двигательной системой. Во время сна он действует двумя путями: холинергическим путем, который проецируется в кору через таламус, и набором моноаминергических путей, которые проецируются в кору через гипоталамус. Во время NREM-сна эта система ингибируется ГАМКергическими нейронами в вентролатеральная преоптическая область и парафациальная зона, as well as other sleep-promoting neurons in distinct brain regions.
Sleep function
The need and function of sleep are among the least clearly understood areas in sleep research. When asked, after 50 years of research, what he knew about the reason people sleep, Уильям К. Демент, Основатель Стэндфордский Университет 's Sleep Research Center, answered, "As far as I know, the only reason we need to sleep that is really, really solid is because we get sleepy."[107] It is likely that sleep evolved to fulfill some primeval function and took on multiple functions over time[108] (analogous to the гортань, which controls the passage of food and air, but спустился over time to develop speech capabilities).
The multiple hypotheses proposed to explain the function of sleep reflect the incomplete understanding of the subject. While some functions of sleep are known, others have been proposed but not completely substantiated or understood. Some of the early ideas about sleep function were based on the fact that most (if not all) external activity is stopped during sleep. Initially, it was thought that sleep was simply a mechanism for the body to "take a break" and reduce wear. Later observations of the low метаболический rates in the brain during sleep seemed to indicate some metabolic functions of sleep.[109] This theory is not fully adequate as sleep only decreases metabolism by about 5–10%.[110][111] With the development of EEG, it was found that the brain has almost continuous internal activity during sleep, leading to the idea that the function could be that of reorganization or specification of neuronal circuits or strengthening of connections.[112][113] These hypotheses are still being explored. Other proposed functions of sleep include- maintaining hormonal balance, temperature regulation and maintaining heart rate.
According to a recent sleep disruption and insomnia review study[114], there are short-term and long-term negative consequences on healthy individuals. The short term consequences include increased stress responsivity and psychosocial issues such as impaired cognitive or academic performance and depression. Experiments indicated that, in healthy children and adults, episodes of fragmented sleep or insomnia increased sympathetic activation, which can disrupt mood and cognition. The long term consequences include metabolic issues such as glucose homeostasis disruption and even tumor formation and increased risks of cancer.
Сохранение
The "Preservation and Protection" theory holds that sleep serves an adaptive function. It protects the animal during that portion of the 24-hour day in which being awake, and hence roaming around, would place the individual at greatest risk.[115] Organisms do not require 24 hours to feed themselves and meet other necessities. From this perspective of adaptation, organisms are safer by staying out of harm's way, where potentially they could be prey to other, stronger organisms. They sleep at times that maximize their safety, given their physical capacities and their habitats.
This theory fails to explain why the brain disengages from the external environment during normal sleep. However, the brain consumes a large proportion of the body's energy at any one time and preservation of energy could only occur by limiting its sensory inputs. Another argument against the theory is that sleep is not simply a passive consequence of removing the animal from the environment, but is a "drive"; animals alter their behaviors in order to obtain sleep.
Therefore, circadian regulation is more than sufficient to explain periods of activity and покой that are adaptive to an organism, but the more peculiar specializations of sleep probably serve different and unknown functions. Moreover, the preservation theory needs to explain why carnivores like lions, which are on top of the пищевая цепочка and thus have little to fear, sleep the most. It has been suggested that they need to minimize energy expenditure when not hunting.
Waste clearance from the brain
During sleep, метаболические отходы продукты, такие как иммуноглобулины, белок fragments or intact proteins like бета-амилоид, may be cleared from the интерстиций через глимфатическая система из лимфа -like channels coursing along периваскулярные пространства и астроцит network of the brain.[116][117][118] According to this model, hollow tubes between the blood vessels and astrocytes act like a водосброс allowing drainage of спинномозговая жидкость carrying wastes out of the brain into systemic blood.[117][118] Such mechanisms, which remain under preliminary research as of 2017, indicate potential ways in which sleep is a regulated maintenance period for brain невосприимчивый functions and clearance of beta-amyloid, a фактор риска за Болезнь Альцгеймера.[117]
Реставрация
Лечение раны has been shown to be affected by sleep.[119]
It has been shown that sleep deprivation affects the иммунная система.[120] It is now possible to state that "sleep loss impairs immune function and immune challenge alters sleep," and it has been suggested that sleep increases white blood cell counts.[121] A 2014 study found that depriving mice of sleep increased cancer growth and dampened the immune system's ability to control cancers.[122]
The effect of sleep duration on соматический growth is not completely known. One study recorded growth, height, and weight, as correlated to parent-reported time in bed in 305 children over a period of nine years (age 1–10). It was found that "the variation of sleep duration among children does not seem to have an effect on growth."[123] It is well established that slow-wave sleep affects гормон роста levels in adult men.[12] During eight hours' sleep, Van Cauter, Leproult, and Plat found that the men with a high percentage of SWS (average 24%) also had high growth hormone secretion, while subjects with a low percentage of SWS (average 9%) had low growth hormone secretion.[46]
There is some supporting evidence of the restorative function of sleep. The sleeping brain has been shown to remove metabolic waste products at a faster rate than during an awake state.[124] While awake, metabolism generates reactive oxygen species, which are damaging to cells. In sleep, metabolic rates decrease and reactive oxygen species generation is reduced allowing restorative processes to take over. It is theorized that sleep helps facilitate the synthesis of molecules that help repair and protect the brain from these harmful elements generated during waking.[125] The metabolic phase during sleep is anabolic; anabolic hormones such as growth hormones (as mentioned above) are secreted preferentially during sleep.
Energy conservation could as well have been accomplished by resting quiescent without shutting off the organism from the environment, potentially a dangerous situation. A sedentary nonsleeping animal is more likely to survive predators, while still preserving energy. Sleep, therefore, seems to serve another purpose, or other purposes, than simply conserving energy. Another potential purpose for sleep could be to restore signal strength in synapses that are activated while awake to a "baseline" level, weakening unnecessary connections that to better facilitate learning and memory functions again the next day; this means the brain is forgetting some of the things we learn each day.[126]
Endocrine function
The secretion of many гормоны is affected by sleep-wake cycles. Например, мелатонин, a hormonal timekeeper, is considered a strongly циркадный hormone, whose secretion increases at dim light and peaks during nocturnal sleep, diminishing with bright light to the eyes.[127] In some organisms melatonin secretion depends on sleep, but in humans it is independent of sleep and depends only on light level. Of course, in humans as well as other animals, such a hormone may facilitate coordination of sleep onset. По аналогии, кортизол и тиреотропный гормон (ТТГ) are strongly circadian and diurnal hormones, mostly independent of sleep.[128] In contrast, other hormones like growth hormone (GH) & пролактин are critically sleep-dependent, and are suppressed in the absence of sleep.[129] GH has maximum increase during SWS while prolactin is secreted early after sleep onset and rises through the night. In some hormones whose secretion is controlled by light level, sleep seems to increase secretion. Almost in all cases, sleep deprivation has detrimental effects. For example, cortisol, which is essential for metabolism (it is so important that animals can die within a week of its deficiency) and affects the ability to withstand noxious stimuli, is increased by waking and during REM sleep.[130] Similarly, TSH increases during nocturnal sleep and decreases with prolonged periods of reduced sleep, but increases during total acute sleep deprivation.[131][132]
Because hormones play a major role in energy balance and metabolism, and sleep plays a critical role in the timing and amplitude of their secretion, sleep has a sizable effect on metabolism. This could explain some of the early theories of sleep function that predicted that sleep has a metabolic regulation role.
Memory processing
According to Plihal & Born, sleep generally increases recalling of previous learning and experiences, and its benefit depends on the phase of sleep and the type of memory.[133] For example, studies based on declarative and procedural memory tasks applied over early and late nocturnal sleep, as well as wakefulness controlled conditions, have been shown that declarative memory improves more during early sleep (dominated by SWS) while procedural memory during late sleep (dominated by REM sleep).[134][135]
Regarding to declarative memory, the functional role of SWS has been associated with hippocampal replays of previously encoded neural patterns that seem to facilitate long-term memories consolidation.[134][135] This assumption is based on the active system consolidation hypothesis, which states that repeated reactivations of newly encoded information in hippocampus during slow oscillations in NREM sleep mediate the stabilization and gradually integration of declarative memory with pre-existing knowledge networks on the cortical level.[136] It assumes the hippocampus might hold information only temporarily and in fast-learning rate, whereas the neocortex is related to long-term storage and slow-learning rate.[134][135][137][138][139] This dialogue between hippocampus and neocortex occurs in parallel with hippocampal sharp-wave ripples и thalamo-cortical spindles, synchrony that drives the formation of spindle-ripple event which seems to be a prerequisite for the formation of long-term memories.[135][137][139][140]
Reactivation of memory also occurs during wakefulness and its function is associated with serving to update the reactivated memory with new encoded information, whereas reactivations during SWS are presented as crucial for memory stabilization.[135] Based on targeted memory reactivation (TMR) experiments that use associated memory cues to triggering memory traces during sleep, several studies have been reassuring the importance of nocturnal reactivations for the formation of persistent memories in neocortical networks, as well as highlighting the possibility of increasing people’s memory performance at declarative recalls.[134][140][138][139][141]
Furthermore, nocturnal reactivation seems to share the same neural oscillatory patterns as reactivation during wakefulness, processes which might be coordinated by theta activity.[142] During wakefulness, theta oscillations have been often related to successful performance in memory tasks, and cued memory reactivations during sleep have been showing that theta activity is significantly stronger in subsequent recognition of cued stimuli as compared to uncued ones, possibly indicating a strengthening of memory traces and lexical integration by cuing during sleep.[143] However, the beneficial effect of TMR for memory consolidation seems to occur only if the cued memories can be related to prior knowledge.[144]
Other studies have been also looking at the specific effects of different stages of sleep on different types of memory. For example, it has been found that sleep deprivation does not significantly affect recognition of faces, but can produce a significant impairment of temporal memory (discriminating which face belonged to which set shown). Sleep deprivation was also found to increase beliefs of being correct, especially if they were wrong. Another study reported that the performance on free recall of a list of nouns is significantly worse when sleep deprived (an average of 2.8 ± 2 words) compared to having a normal night of sleep (4.7 ± 4 words). These results reinforce the role of sleep on declarative memory формирование. This has been further confirmed by observations of low metabolic activity in the префронтальная кора и временный и parietal lobes for the temporal learning and verbal learning tasks respectively. Data analysis has also shown that the neural assemblies during SWS correlated significantly more with templates than during waking hours or REM sleep. Also, post-learning, post-SWS reverberations lasted 48 hours, much longer than the duration of novel object learning (1 hour), indicating долгосрочное потенцирование.
Moreover, observations include the importance of дремать: improved performance in some kinds of tasks after a 1-hour afternoon nap; studies of performance of shift workers, showing that an equal number of hours of sleep in the day is not the same as in the night. Current research studies look at the molecular and physiological basis of консолидация памяти during sleep. These, along with studies of genes that may play a role in this phenomenon, together promise to give a more complete picture of the role of sleep in memory.
Renormalizing the synaptic strength
Sleep can also serve to weaken synaptic connections that were acquired over the course of the day but which are not essential to optimal functioning. In doing so, the resource demands can be lessened, since the upkeep and strengthening of synaptic connections constitutes a large portion of energy consumption by the brain and tax other cellular mechanisms such as синтез белка for new channels.[126][145] Without a mechanism like this taking place during sleep, the metabolic needs of the brain would increase over repeated exposure to daily synaptic strengthening, up to a point where the strains become excessive or untenable.
Behavior change with sleep deprivation
One approach to understanding the role of sleep is to study the deprivation of it.[146] Недосыпание is common and sometimes even necessary in modern societies because of occupational and domestic reasons like round-the-clock service, security or media coverage, cross-time-zone projects etc. This makes understanding the effects of sleep deprivation very important.
Many studies have been done from the early 1900s to document the effect of sleep deprivation. The study of REM deprivation began with Уильям К. Демент more than fifty years ago. He conducted a sleep and dream research project on eight subjects, all male. For a span of up to 7 days, he deprived the participants of REM sleep by waking them each time they started to enter the stage. He monitored this with small electrodes attached to their scalp and temples. As the study went on, he noticed that the more he deprived the men of REM sleep, the more often he had to wake them. Afterwards, they showed more REM sleep than usual, later named REM rebound.[147][148]
В neurobehavioral basis for these has been studied only recently. Sleep deprivation has been strongly correlated with increased probability of accidents and industrial errors.[149][150] Many studies have shown the slowing of metabolic activity in the brain with many hours of sleep debt.[131] Some studies have also shown that the внимание network in the brain is particularly affected by lack of sleep,[151] and though some of the effects on attention may be masked by alternate activities (like standing or walking) or caffeine consumption,[152] attention deficit cannot be completely avoided.
Sleep deprivation has been shown to have a detrimental effect on cognitive tasks, especially involving divergent functions or multitasking.[149][153][154] It also has effects on mood and emotion, and there have been multiple reports of increased tendency for rage, fear or depression with sleep debt.[155][156] However, some of the higher cognitive functions seem to remain unaffected albeit slower.[153] Many of these effects vary from person to person[157] i.e. while some individuals have high degrees of cognitive impairment with lack of sleep, in others, it has minimal effects. The exact mechanisms for the above are still unknown and the exact neural pathways and cellular mechanisms of sleep debt are still being researched.
Нарушения сна
A sleep disorder, or somnipathy, is a medical disorder of the sleep patterns of a person or animal. Полисомнография is a test commonly used for diagnosing some sleep disorders. Sleep disorders are broadly classified into диссомнии, парасомнии, нарушения циркадного ритма сна (CRSD), and other disorders including ones caused by medical or psychological conditions and сонная болезнь. Some common sleep disorders include бессонница (chronic inability to sleep), апноэ во сне (abnormally low breathing during sleep), нарколепсия (excessive sleepiness at inappropriate times), катаплексия (sudden and transient loss of muscle tone), and sleeping sickness (disruption of sleep cycle due to infection). Other disorders that are being studied include лунатизм, sleep terror и bed wetting.
Studying sleep disorders is particularly useful as it gives some clues as to which parts of the brain may be involved in the modified function. This is done by comparing the imaging and histological patterns in normal and affected subjects. Treatment of sleep disorders typically involves behavioral and психотерапевтический methods though other techniques may also be used. The choice of treatment methodology for a specific patient depends on the patient's diagnosis, medical and psychiatric history, and preferences, as well as the expertise of the treating clinician. Often, behavioral or psychotherapeutic and фармакологический approaches are compatible and can effectively be combined to maximize therapeutic benefits.
Frequently, sleep disorders have been also associated with neurodegenerative diseases, mainly when they are characterized by abnormal accumulation of альфа-синуклеин, Такие как множественная системная атрофия (MSA), болезнь Паркинсона (PD) and Lewy body disease (LBD).[158][54][159][56][160][161][162] For instance, people diagnosed with PD have often presented different kinds of sleep concerns, commonly regard to бессонница (around 70% of the PD population), гиперсомния (more than 50% of the PD population), and Расстройство быстрого сна (RBD) - that may affect around 40% of the PD population and it is associated with increased motor symptoms.[158][54][159][56][160][162] Furthermore, RBD has been also highlighted as a strong precursor of future development of those neurodegenerative diseases over several years in prior, which seems to be a great opportunity for improving treatments.[54][56]
Sleep disturbances have been also observed in Болезнь Альцгеймера (AD), affecting about 45% of its population.[54][56][161] Moreover, when it is based on caregiver reports this percentage is even higher, about 70%.[163] As well as in PD population, бессонница и гиперсомния are frequently recognized in AD patients, which are associated with accumulation of Бета-амилоид, нарушения циркадного ритма сна (CRSD) and мелатонин внесение изменений.[54][56][163] Additionally, changes in sleep architecture are observed in AD too.[54][56][161] Even though with ageing the sleep architecture seems to change naturally, in AD patients it is aggravated. SWS is potentially decreased (sometimes totally absent), spindles and the time spent in REM sleep are also reduced, while its latency is increased.[163] The poorly sleep onset in AD has been also associated with dream-related hallucination, increased restlessness, wandering and agitation, that seem to be related with sundowning - a typical chronobiological phenomenon presented in the disease.[56][163]
The neurodegenerative conditions are commonly related to brain structures impairments, which might disrupt the states of sleep and wakefulness, circadian rhythm, motor or non motor functioning.[54][56] On the other hand, sleep disturbances are also frequently related to worsening patient's cognitive functioning, emotional state and quality of life.[56][162][163] Furthermore, these abnormal behavioural symptoms negatively contribute to overwhelming their relatives and caregivers.[56][162][163] Therefore, a deeper understanding of the relationship between sleep disorders and neurodegenerative diseases seems to be extremely important, mainly considering the limited research related to it and the increasing expectancy of life.[54][163]
A related field is that of sleep medicine which involves the diagnosis and therapy of sleep disorders and sleep deprivation, which is a major cause of accidents. This involves a variety of diagnostic methods including polysomnography, дневник сна, multiple sleep latency test, etc. Similarly, treatment may be behavioral such as когнитивно-поведенческая терапия or may include pharmacological medication or яркая световая терапия.
Сновидение

Dreams are successions of images, ideas, emotions, and sensations that occur involuntarily in the mind during certain stages of sleep (mainly the REM stage). The content and purpose of dreams are not yet clearly understood though various theories have been proposed. The scientific study of dreams is called онейрология.
There are many theories about the neurological basis of dreaming. Это включает activation synthesis theory —the theory that dreams result from brain stem activation during REM sleep; the continual activation theory—the theory that dreaming is a result of activation and synthesis but dreams and REM sleep are controlled by different structures in the brain; and dreams as excitations of long term memory—a theory which claims that long term memory excitations are prevalent during waking hours as well but are usually controlled and become apparent only during sleep.
There are multiple theories about dream function as well. Some studies claim that dreams strengthen semantic memories. This is based on the role of hippocampal neocortical dialog and general connections between sleep and memory. One study surmises that dreams erase junk data in the brain. Emotional adaptation и регулирование настроения are other proposed functions of dreaming.
Из эволюционный standpoint, dreams might simulate and rehearse threatening events, that were common in the organism's ancestral environment, hence increasing a persons ability to tackle everyday problems and challenges in the present. For this reason these threatening events may have been passed on in the form of genetic memories.[164][165] This theory accords well with the claim that REM sleep is an evolutionary transformation of a well-known defensive mechanism, the tonic immobility reflex.[42][43]
Most theories of dream function appear to be conflicting, but it is possible that many short-term dream functions could act together to achieve a bigger long-term function.[7] It may be noted that evidence for none of these theories is entirely conclusive.
The incorporation of waking memory events into dreams is another area of active research and some researchers have tried to link it to the declarative memory consolidation functions of dreaming.[166][167]
A related area of research is the neuroscience basis of кошмары. Many studies have confirmed a high prevalence of nightmares and some have correlated them with high стресс уровни.[168] Multiple models of nightmare production have been proposed including neo-Фрейдист models as well as other models such as image contextualization model, boundary thickness model, threat simulation model etc.[169] Нейротрансмиттер imbalance has been proposed as a cause of nightmares, as also affective network dysfunction- a model which claims that nightmare is a product of dysfunction of circuitry normally involved in dreaming.[170][171] As with dreaming, none of the models have yielded conclusive results and studies continue about these questions.
Смотрите также
Рекомендации
- ^ "A brief history of sleep research".
- ^ "NCBI Sleep Guide". Архивировано из оригинал on 2007-01-10.
- ^ Cirelli C, Shaw PJ, Rechtschaffen A, Tononi G (September 1999). "No evidence of brain cell degeneration after long-term sleep deprivation in rats". Исследование мозга. 840 (1–2): 184–93. Дои:10.1016/s0006-8993(99)01768-0. PMID 10517970. S2CID 592724.
- ^ Stickgold R, Valker MP (22 May 2010). The Neuroscience of Sleep. п. xiii. ISBN 9780123757227. Получено 18 июля 2015.
- ^ Konnikova M (8 July 2015). "The Work We Do While We Sleep". Житель Нью-Йорка. Получено 17 июля 2015.
The Harvard sleep researcher Роберт Стикголд has recalled his former collaborator Дж. Аллан Хобсон joking that the only known function of sleep is to cure sleepiness.
- ^ Kilduff TS, Lein ES, de la Iglesia H, Sakurai T, Fu YH, Shaw P (November 2008). "New developments in sleep research: molecular genetics, gene expression, and systems neurobiology". Журнал неврологии. 28 (46): 11814–8. Дои:10.1523/JNEUROSCI.3768-08.2008. ЧВК 2628168. PMID 19005045.
- ^ а б c d Stickgold, Robert (2009). The Neuroscience of Sleep. Amsterdam: Boston : Academic Press/Elsevier. стр.61 –86. ISBN 9780123750730.
- ^ J. Alan Hobson, Edward F. Pace-Scott, & Robert Stickgold (2000), "Dreaming and the brain: Toward a cognitive neuroscience of conscious states", Поведенческие науки и науки о мозге 23.
- ^ коричневый, pp. 1100–1102.
- ^ коричневый, pp. 1118–1119: "Compared with wakefulness, sleep reduces brain energy demands, as suggested by the 44% reduction in the cerebral metabolic rate (CMR) of glucose (791) and a 25% reduction in the CMR of O2 (774) during sleep."
- ^ Siegel JM (April 2008). "Do all animals sleep?". Тенденции в неврологии. 31 (4): 208–13. Дои:10.1016/j.tins.2008.02.001. PMID 18328577. S2CID 6614359.
- ^ а б Eve Van Cauter & Karine Spiegel (1999). "Circadian and Sleep Control of Hormonal Secretions", in Turek & Zee (eds.), Regulation of Sleep and Circadian Rhythms, pp. 397–425.
- ^ Hobson JA, McCarley RW (December 1977). "The brain as a dream state generator: an activation-synthesis hypothesis of the dream process". Американский журнал психиатрии. 134 (12): 1335–48. Дои:10.1176/ajp.134.12.1335. PMID 21570.
- ^ "Online Free Medical Dictionary".
- ^ Anch, A. Michael (1988). Sleep : a scientific perspective. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 9780138129187.
- ^ Thorpy MJ, Yager J (2001). The encyclopedia of sleep and sleep disorders (2-е изд.). Нью-Йорк: факты в файле. ISBN 978-0-8160-4089-6.
- ^ Magnin M, Rey M, Bastuji H, Guillemant P, Mauguière F, Garcia-Larrea L (February 2010). "Thalamic deactivation at sleep onset precedes that of the cerebral cortex in humans". Труды Национальной академии наук Соединенных Штатов Америки. 107 (8): 3829–33. Bibcode:2010PNAS..107.3829M. Дои:10.1073/pnas.0909710107. ЧВК 2840430. PMID 20142493.
- ^ Jones EG (March 2009). "Synchrony in the interconnected circuitry of the thalamus and cerebral cortex". Летопись Нью-Йоркской академии наук. 1157 (1): 10–23. Bibcode:2009NYASA1157...10J. Дои:10.1111/j.1749-6632.2009.04534.x. PMID 19351352. S2CID 19140386.
- ^ Somers VK, Dyken ME, Mark AL, Abboud FM (February 1993). "Sympathetic-nerve activity during sleep in normal subjects". Медицинский журнал Новой Англии. 328 (5): 303–7. Дои:10.1056/NEJM199302043280502. PMID 8419815.
- ^ Tononi G, Cirelli C (February 2006). "Sleep function and synaptic homeostasis". Отзывы о медицине сна. 10 (1): 49–62. Дои:10.1016/j.smrv.2005.05.002. PMID 16376591.
- ^ а б Dement W, Kleitman N (November 1957). «Циклические вариации ЭЭГ во время сна и их связь с движениями глаз, подвижностью тела и сновидениями». Электроэнцефалография и клиническая нейрофизиология. 9 (4): 673–90. Дои:10.1016/0013-4694(57)90088-3. PMID 13480240.
- ^ Hughes JR (July 2008). "Gamma, fast, and ultrafast waves of the brain: their relationships with epilepsy and behavior". Эпилепсия и поведение. 13 (1): 25–31. Дои:10.1016/j.yebeh.2008.01.011. PMID 18439878. S2CID 19484309.
- ^ Barker W, Burgwin S (Nov–Dec 1948). "Brain wave patterns accompanying changes in sleep and wakefulness during hypnosis". Психосоматическая медицина. 10 (6): 317–26. Дои:10.1097/00006842-194811000-00002. PMID 18106841. S2CID 31249127.
- ^ Jankel WR, Niedermeyer E (January 1985). "Sleep spindles". Журнал клинической нейрофизиологии. 2 (1): 1–35. Дои:10.1097/00004691-198501000-00001. PMID 3932462. S2CID 44570089.
- ^ а б Hofle N, Paus T, Reutens D, Fiset P, Gotman J, Evans AC, Jones BE (June 1997). "Regional cerebral blood flow changes as a function of delta and spindle activity during slow wave sleep in humans". Журнал неврологии. 17 (12): 4800–8. Дои:10.1523/JNEUROSCI.17-12-04800.1997. ЧВК 6573353. PMID 9169538.
- ^ Oswald I, Taylor AM, Treisman M (September 1960). "Discriminative responses to stimulation during human sleep". Мозг. 83 (3): 440–53. Дои:10.1093/brain/83.3.440. PMID 13731563.
- ^ Loomis AL, Harvey EN, Hobart GA (1938). "Distribution of disturbance-patterns in the human electroencephalogram with special reference to sleep". Журнал нейрофизиологии. 1 (5): 413–430. Дои:10.1152/jn.1938.1.5.413.
- ^ Dumermuth G, Walz W, Scollo-Lavizzari G, Kleiner B (1 January 1972). "Spectral analysis of EEG activity in different sleep stages in normal adults". Европейская неврология. 7 (5): 265–96. Дои:10.1159/000114432. PMID 4339034.
- ^ McNamara, P., R. A. Barton, and C. L. Nunn. 2010, Evolution of sleep: Phylogenetic and functional perspectives. Издательство Кембриджского университета, Кембридж.
- ^ Capellini I, Nunn CL, McNamara P, Preston BT, Barton RA (October 2008). "Energetic constraints, not predation, influence the evolution of sleep patterning in mammals". Функциональная экология. 22 (5): 847–853. Дои:10.1111/j.1365-2435.2008.01449.x. ЧВК 2860325. PMID 20428321.
- ^ Acerbi A, McNamara P, Nunn CL (May 2008). "To sleep or not to sleep: the ecology of sleep in artificial organisms". BMC Ecology. 8: 10. Дои:10.1186/1472-6785-8-10. ЧВК 2396600. PMID 18479523.
- ^ Preston, B. T., I. Capellini, P. McNamara, R. A. Barton, and C. L. Nunn. 2009. Parasite resistance and the adaptive significance of sleep. Bmc Evolutionary Biology 9.
- ^ Allison T, Van Twyver H, Goff WR (July 1972). "Electrophysiological studies of the echidna, Tachyglossus aculeatus. I. Waking and sleep". Archives Italiennes de Biologie. 110 (2): 145–84. PMID 4342268.
- ^ Siegel JM, Manger PR, Nienhuis R, Fahringer HM, Pettigrew JD (May 1996). "The echidna Tachyglossus aculeatus combines REM and non-REM aspects in a single sleep state: implications for the evolution of sleep". Журнал неврологии. 16 (10): 3500–6. Дои:10.1523/JNEUROSCI.16-10-03500.1996. ЧВК 6579141. PMID 8627382.
- ^ Mukhametov, Lev M. (1987). "Unihemispheric slow-wave sleep in the Amazonian dolphin, Inia geoffrensis". Письма о неврологии. 79 (1–2): 128–132. Дои:10.1016/0304-3940(87)90684-7. PMID 3670722. S2CID 30316737.
- ^ Lyamin OI, Mukhametov LM, Siegel JM, Nazarenko EA, Polyakova IG, Shpak OV (February 2002). "Unihemispheric slow wave sleep and the state of the eyes in a white whale". Поведенческие исследования мозга. 129 (1–2): 125–9. Дои:10.1016/S0166-4328(01)00346-1. PMID 11809503. S2CID 27009685.
- ^ Roth TC, Lesku JA, Amlaner CJ, Lima SL (December 2006). "A phylogenetic analysis of the correlates of sleep in birds". Журнал исследований сна. 15 (4): 395–402. Дои:10.1111/j.1365-2869.2006.00559.x. PMID 17118096.
- ^ Mascetti GG, Bobbo D, Rugger M, Vallortigara G (August 2004). "Monocular sleep in male domestic chicks". Поведенческие исследования мозга. 153 (2): 447–52. Дои:10.1016/j.bbr.2003.12.022. PMID 15265641. S2CID 19793594.
- ^ Rattenborg NC, Lima SL, Amlaner CJ (November 1999). «Факультативный контроль однополушарного сна птиц в условиях риска хищничества». Поведенческие исследования мозга. 105 (2): 163–72. Дои:10.1016 / S0166-4328 (99) 00070-4. PMID 10563490. S2CID 8570743.
- ^ Shaw, P. J. (2000). "Correlates of Sleep and Waking in Drosophila melanogaster". Наука. 287 (5459): 1834–1837. Bibcode:2000Sci...287.1834S. Дои:10.1126/science.287.5459.1834. PMID 10710313.
- ^ Sauer S, Kinkelin M, Herrmann E, Kaiser W (August 2003). "The dynamics of sleep-like behaviour in honey bees". Журнал сравнительной физиологии А. 189 (8): 599–607. Дои:10.1007/s00359-003-0436-9. PMID 12861424. S2CID 13603649.
- ^ а б Tsoukalas, Ioannis (2012). "The origin of REM sleep: A hypothesis". Сновидение. 22 (4): 253–283. Дои:10.1037/a0030790.
- ^ а б Vitelli, R. (2013). Exploring the Mystery of REM Sleep. Психология сегодня, On-line blog, 25 March
- ^ Parmelee AH, Wenner WH, Schulz HR (1 October 1964). "Infant sleep patterns: From birth to 16 weeks of age". Журнал педиатрии. 65 (4): 576–582. Дои:10.1016/S0022-3476(64)80291-2. PMID 14216645.
- ^ а б Gertner S, Greenbaum CW, Sadeh A, Dolfin Z, Sirota L, Ben-Nun Y (July 2002). "Sleep-wake patterns in preterm infants and 6 month's home environment: implications for early cognitive development". Раннее человеческое развитие. 68 (2): 93–102. Дои:10.1016/S0378-3782(02)00018-X. PMID 12113995.
- ^ а б Van Cauter E, Leproult R, Plat L (August 2000). "Age-related changes in slow wave sleep and REM sleep and relationship with growth hormone and cortisol levels in healthy men". JAMA. 284 (7): 861–8. Дои:10.1001/jama.284.7.861. PMID 10938176.
- ^ Roffwarg HP, Muzio JN, Dement WC (April 1966). «Онтогенетическое развитие цикла сна-сна человека». Наука. 152 (3722): 604–19. Bibcode:1966Sci...152..604R. Дои:10.1126 / science.152.3722.604. PMID 17779492.
- ^ Ibuka, Nobuo (1984). "Ontogenesis of circadian sleep-wakefulness rhythms and developmental changes of sleep in the altricial rat and in the precocial guinea pig". Поведенческие исследования мозга. 11 (3): 185–196. Дои:10.1016/0166-4328(84)90210-9. PMID 6721913. S2CID 11458572.
- ^ Carskadon MA, Wolfson AR, Acebo C, Tzischinsky O, Seifer R (December 1998). "Adolescent sleep patterns, circadian timing, and sleepiness at a transition to early school days". Спать. 21 (8): 871–81. Дои:10.1093 / сон / 21.8.871. PMID 9871949.
- ^ Wolfson AR, Carskadon MA (August 1998). "Sleep schedules and daytime functioning in adolescents". Развитие ребенка. 69 (4): 875–87. Дои:10.1111 / j.1467-8624.1998.tb06149.x. PMID 9768476.
- ^ а б c Ohayon M, Carskadon M, Guilleminault C, Vitiello M (2004). "Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: Developing normative sleep values across the human lifespan". Спать. 27 (7): 1255–73. Дои:10.1093/sleep/27.7.1255. PMID 15586779.
- ^ а б Backhaus J, Born J, Hoeckesfeld R, Fokuhl S, Hohagen F, Junghanns K (2007). "Midlife Decline in Declarative Memory Consolidation Is Correlated with a Decline in Slow Wave Sleep". Learning & Memory. 14 (5): 336–341. Дои:10.1101/lm.470507. ЧВК 1876757. PMID 17522024.
- ^ а б Mander, B., Rao, V., Lu, B., Saletin, J., Lindquist, J., Ancoli-Israel, S., . . . Walker, M. (2013). Prefrontal atrophy, disrupted NREM slow waves and impaired hippocampal-dependent memory in aging. 357 - 364.
- ^ а б c d е ж грамм час я j Zhong N, Rogers, Lewis (2011). "Sleep–wake disturbances in common neurodegenerative diseases: A closer look at selected aspects of the neural circuitry". Журнал неврологических наук. 307 (1–2): 9–14. Дои:10.1016/j.jns.2011.04.020. PMID 21570695. S2CID 44744844.
- ^ Cordi M, Schlarb A, Rasch B (2014). "Deepening sleep by hypnotic suggestion". Спать. 37 (6): 1143–52. Дои:10.5665/sleep.3778. ЧВК 4015388. PMID 24882909.
- ^ а б c d е ж грамм час я j k л Malkani R, Attarian H (2015). "Sleep in Neurodegenerative Disorders". Current Sleep Medicine Reports. 1 (2): 81–90. Дои:10.1007/s40675-015-0016-x.
- ^ Weitzman ED, Czeisler CA, Coleman RM, Spielman AJ, Zimmerman JC, Dement W, Richardson G, Pollak CP (July 1981). "Delayed sleep phase syndrome. A chronobiological disorder with sleep-onset insomnia". Архив общей психиатрии. 38 (7): 737–46. Дои:10.1001/archpsyc.1981.01780320017001. PMID 7247637.
- ^ Myers BL, Badia P (1995). "Changes in circadian rhythms and sleep quality with aging: mechanisms and interventions". Неврология и биоповеденческие обзоры. 19 (4): 553–71. Дои:10.1016/0149-7634(95)00018-6. PMID 8684716. S2CID 23651761.
- ^ Borbély AA (1 January 1998). "Processes underlying sleep regulation" (PDF). Гормональные исследования. 49 (3–4): 114–7. Дои:10.1159/000023156. PMID 9550110. S2CID 15651050.
- ^ Mazoyer B, Houdé O, Joliot M, Mellet E, Tzourio-Mazoyer N (September 2009). "Regional cerebral blood flow increases during wakeful rest following cognitive training". Бюллетень исследований мозга. 80 (3): 133–8. Дои:10.1016/j.brainresbull.2009.06.021. PMID 19589374. S2CID 22696285.
- ^ Loomis AL, Harvey EN, Hobart GA (1937). "III Cerebral states during sleep, as studied by human brain potentials". J. Exp. Психол. 21 (2): 127–44. Дои:10.1037/h0057431.
- ^ а б коричневый, pp. 1108–1109.
- ^ а б Rechtschaffen A, Kales A, eds. (1968). A Manual of Standardized Terminology, Techniques and Scoring System for Sleep Stages of Human Subjects (PDF). Washington: Public Health Service, US Government Printing Office.
- ^ Iber C, Ancoli-Israel S, Chesson A, Quan SF, American Academy of Sleep Medicine (2007). The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications. Westchester: American Academy of Sleep Medicine.
- ^ "Stages of Sleep" (PDF). Psychology World. 1998. Получено 15 июн 2008.
(includes illustrations of "sleep spindles" and "K-complexes")
- ^ Schulz H (April 2008). "Rethinking sleep analysis". Журнал клинической медицины сна. 4 (2): 99–103. Дои:10.5664/jcsm.27124. ЧВК 2335403. PMID 18468306.
- ^ Parmeggiani (2011), Systemic Homeostasis and Poikilostasis in Sleep, пассим.
- ^ Braun, A. (1997). "Regional cerebral blood flow throughout the sleep-wake cycle. An H2(15)O PET study". Мозг. 120 (7): 1173–1197. Дои:10.1093/brain/120.7.1173. PMID 9236630.
- ^ McGinty DJ, Sterman MB (June 1968). "Sleep suppression after basal forebrain lesions in the cat". Наука. 160 (3833): 1253–5. Bibcode:1968Sci...160.1253M. Дои:10.1126/science.160.3833.1253. PMID 5689683. S2CID 24677928.
- ^ Hutt, Axel, ed. (2011-07-12). Sleep and anesthesia : neural correlates in theory and experiment. Нью-Йорк: Спрингер. ISBN 9781461401728.
- ^ Steriade, M (1997). "Synchronized activities of coupled oscillators in the cerebral cortex and thalamus at different levels of vigilance [published erratum appears in Cereb Cortex 1997 Dec;7(8):779]". Кора головного мозга. 7 (6): 583–604. Дои:10.1093/cercor/7.6.583. PMID 9276182.
- ^ Contreras D, Destexhe A, Sejnowski TJ, Steriade M (February 1997). "Spatiotemporal patterns of spindle oscillations in cortex and thalamus". Журнал неврологии. 17 (3): 1179–96. Дои:10.1523/JNEUROSCI.17-03-01179.1997. ЧВК 6573181. PMID 8994070.
- ^ а б Fuller PM, Gooley JJ, Saper CB (December 2006). "Neurobiology of the sleep-wake cycle: sleep architecture, circadian regulation, and regulatory feedback". Журнал биологических ритмов. 21 (6): 482–93. Дои:10.1177/0748730406294627. PMID 17107938. S2CID 36572447.
- ^ а б Daniel L S, Gilbert DT, Wegner DM (2009). Психология. Стоит издателям. ISBN 978-1-4292-0615-0.
- ^ Waterhouse J, Fukuda Y, Morita T (March 2012). "Daily rhythms of the sleep-wake cycle". Журнал физиологической антропологии. 31: 5. Дои:10.1186/1880-6805-31-5. ЧВК 3375033. PMID 22738268.
- ^ Myers DG (22 September 2003). Psychology, Seventh Edition, in Modules (High School Version). Макмиллан. С. 268–. ISBN 978-0-7167-8595-8. Получено 22 августа 2012.
- ^ Саладин, Кеннет С. (2012). Anatomy and Physiology: The Unity of Form and Function, 6th Edition. Макгроу-Хилл. п. 537. ISBN 978-0-07-337825-1.
- ^ а б Reivich M, Isaacs G, Evarts E, Kety S (April 1968). "The effect of slow wave sleep and REM sleep on regional cerebral blood flow in cats". Журнал нейрохимии. 15 (4): 301–6. Дои:10.1111/j.1471-4159.1968.tb11614.x. PMID 5641651. S2CID 27688214.
- ^ Maquet P, Péters J, Aerts J, Delfiore G, Degueldre C, Luxen A, Franck G (September 1996). "Functional neuroanatomy of human rapid-eye-movement sleep and dreaming" (PDF). Природа. 383 (6596): 163–6. Bibcode:1996Natur.383..163M. Дои:10.1038/383163a0. PMID 8774879. S2CID 19628239. Архивировано из оригинал (PDF) на 2010-07-05. Получено 2012-07-28.
- ^ а б Saper CB, Scammell TE, Lu J (October 2005). "Hypothalamic regulation of sleep and circadian rhythms". Природа. 437 (7063): 1257–63. Bibcode:2005Natur.437.1257S. Дои:10.1038/nature04284. PMID 16251950. S2CID 1793658.
- ^ Siegel, Jerome M (1999). "Спать". Энциклопедия Encarta. Microsoft. Архивировано из оригинал 14 декабря 2007 г.. Получено 25 января 2008.
- ^ Siegel JM (June 2006). "The stuff dreams are made of: anatomical substrates of REM sleep". Природа Неврология. 9 (6): 721–2. Дои:10.1038/nn0606-721. PMID 16732200. S2CID 7951497.
- ^ Nelson JP, McCarley RW, Hobson JA (October 1983). "REM sleep burst neurons, PGO waves, and eye movement information". Журнал нейрофизиологии. 50 (4): 784–97. Дои:10.1152/jn.1983.50.4.784. PMID 6631463.
- ^ Hobson JA, Stickgold R, Pace-Schott EF (February 1998). "The neuropsychology of REM sleep dreaming". NeuroReport. 9 (3): R1–14. Дои:10.1097/00001756-199802160-00033. PMID 9512371.
- ^ Wilson MA, McNaughton BL (July 1994). "Reactivation of hippocampal ensemble memories during sleep". Наука. 265 (5172): 676–9. Bibcode:1994Sci...265..676W. Дои:10.1126/science.8036517. PMID 8036517.
- ^ Stickgold R, Walker MP (June 2007). "Sleep-dependent memory consolidation and reconsolidation". Медицина Сна. 8 (4): 331–43. Дои:10.1016/j.sleep.2007.03.011. ЧВК 2680680. PMID 17470412.
- ^ Бужаки, Г. (1 января 1996 г.). "Гиппокампо-неокортикальный диалог". Кора головного мозга. 6 (2): 81–92. Дои:10.1093 / cercor / 6.2.81. PMID 8670641.
- ^ Бузак, Дьёрдь (1 июня 1998 г.). «Консолидация памяти во время сна: нейрофизиологическая перспектива». Журнал исследований сна. 7 (S1): 17–23. Дои:10.1046 / j.1365-2869.7.s1.3.x. PMID 9682189.
- ^ Феррара М., Морони Ф, Де Дженнаро Л., Нобили Л. (1 января 2012 г.). «Особенности сна гиппокампа: связь с функцией памяти человека». Границы неврологии. 3: 57. Дои:10.3389 / fneur.2012.00057. ЧВК 3327976. PMID 22529835.
- ^ "Основы сна Гарвардской медицинской школы".
- ^ Сигел, Джером Х. (2002). Нейронный контроль сна и бодрствования. Springer. ISBN 9780387955360.
- ^ а б Saper CB, Chou TC, Scammell TE (декабрь 2001 г.). «Переключатель сна: гипоталамический контроль сна и бодрствования». Тенденции в неврологии. 24 (12): 726–31. Дои:10.1016 / S0166-2236 (00) 02002-6. PMID 11718878. S2CID 206027570.
- ^ Лу Дж., Шерман Д., Девор М., Сапер CB (июнь 2006 г.). «Предполагаемый триггер для управления быстрым сном». Природа. 441 (7093): 589–94. Bibcode:2006Натура.441..589L. Дои:10.1038 / природа04767. PMID 16688184. S2CID 4408007.
- ^ Салланон М., Денуайер М., Китахама К., Обер К., Гей Н., Жуве М. (1989). «Длительная бессонница, вызванная преоптическими поражениями нейронов, и ее временное устранение путем инъекции мусцимола в задний гипоталамус у кошек». Неврология. 32 (3): 669–83. Дои:10.1016/0306-4522(89)90289-3. PMID 2601839. S2CID 5791711.
- ^ Swett CP, Hobson JA (сентябрь 1968 г.). «Влияние поражений заднего гипоталамуса на поведенческие и электрографические проявления сна и бодрствования у кошек». Archives Italiennes de Biologie. 106 (3): 283–93. PMID 5724423.
- ^ Борбели А.А. (1982). «Двухпроцессная модель регуляции сна». Человеческая нейробиология. 1 (3): 195–204. PMID 7185792.
- ^ Эдгар Д.М., Демент В.К., Фуллер Калифорния (март 1993 г.). «Влияние поражений SCN на сон у беличьих обезьян: данные о противодействующих процессах в регуляции сна и бодрствования». Журнал неврологии. 13 (3): 1065–79. Дои:10.1523 / JNEUROSCI.13-03-01065.1993. ЧВК 6576589. PMID 8441003.
- ^ Бирендра Н. Маллик; и др., ред. (2011-07-14). Сон с быстрым движением глаз: регуляция и функции. Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 9780521116800.
- ^ Маккормик Д.А., Бал Т. (1 марта 1997 г.). «Сон и возбуждение: таламокортикальные механизмы». Ежегодный обзор нейробиологии. 20 (1): 185–215. Дои:10.1146 / annurev.neuro.20.1.185. PMID 9056712.
- ^ Sforza E, Montagna P, Tinuper P, Cortelli P, Avoni P, Ferrillo F, Petersen R, Gambetti P, Lugaresi E (июнь 1995 г.). «Нарушения цикла сна-бодрствования при фатальной семейной бессоннице. Доказательства роли таламуса в регуляции сна». Электроэнцефалография и клиническая нейрофизиология. 94 (6): 398–405. Дои:10.1016 / 0013-4694 (94) 00318-Ф. PMID 7607093.
- ^ Тинупер П., Монтанья П., Медори Р., Кортелли П., Цуккони М., Баруцци А., Лугареси Е. (август 1989 г.). «Таламус участвует в регуляции цикла сна и бодрствования. Клинико-патологическое исследование фатальной семейной таламической дегенерации». Электроэнцефалография и клиническая нейрофизиология. 73 (2): 117–23. Дои:10.1016/0013-4694(89)90190-9. PMID 2473878.
- ^ Кулон П., Будде Т., Папе Х.С. (январь 2012 г.). «Реле сна - роль таламуса в центральной и децентрализованной регуляции сна». Pflügers Archiv. 463 (1): 53–71. Дои:10.1007 / s00424-011-1014-6. PMID 21912835. S2CID 15459459.
- ^ Iwańczuk W, Guźniczak P (2015). «Нейрофизиологические основы феноменов сна, возбуждения, осознавания и сознания. Часть 1». Анестезиология Интенсивная терапия. 47 (2): 162–7. Дои:10.5603 / AIT.2015.0015. PMID 25940332.
Восходящая ретикулярная активирующая система (ВРАС) отвечает за длительное состояние бодрствования. Он получает информацию от сенсорных рецепторов различных модальностей, передаваемых через спиноретикулярные пути и черепные нервы (тройничный нерв - полимодальные пути, обонятельный нерв, зрительный нерв и вестибулокохлеарный нерв - мономодальные пути). Эти пути достигают таламуса прямо или косвенно через медиальный столб ядер ретикулярной формации (межклеточные ядра и ретикулярные ядра pontine tegmentum). Ретикулярная активирующая система начинается в дорсальной части заднего среднего мозга и переднего моста, продолжается в промежуточный мозг, а затем делится на две части, достигая таламуса и гипоталамуса, которые затем выступают в кору головного мозга (рис. 1). В таламической проекции преобладают холинергические нейроны, происходящие из педункулопонтинного тегментального ядра моста и среднего мозга (PPT) и латеродорсального тегментального ядра моста и ядер среднего мозга (LDT) [17, 18]. Гипоталамическая проекция включает норадренергические нейроны голубого пятна (LC) и серотонинергические нейроны дорсального и срединного ядер шва (DR), которые проходят через латеральный гипоталамус и достигают аксонов гистаминергического туберомамиллярного ядра (TMN), вместе формируя путь, идущий в передний мозг, кору и гиппокамп. Кортикальное возбуждение также использует дофаминергические нейроны черной субстанции (SN), вентральной области надкрылий (VTA) и периакведуктальной серой зоны (PAG). Меньшее количество холинергических нейронов моста и среднего мозга посылает проекции в передний мозг по вентральному пути, минуя таламус [19, 20].
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 12: Сон и возбуждение». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк, США: McGraw-Hill Medical. п. 295. ISBN 9780071481274.
РАС представляет собой сложную структуру, состоящую из нескольких различных цепей, включая четыре моноаминергических пути ... Путь норэпинефрина берет свое начало от голубого пятна (ЦК) и связанных ядер ствола мозга; серотонинергические нейроны также происходят из ядер шва в стволе мозга; дофаминергические нейроны берут начало в вентральной тегментальной области (VTA); а гистаминергический путь происходит от нейронов туберомаммиллярного ядра (TMN) заднего гипоталамуса. Как обсуждалось в главе 6, эти нейроны широко распространяются по всему мозгу из ограниченных скоплений клеточных тел. Норэпинефрин, серотонин, дофамин и гистамин обладают сложными модулирующими функциями и в целом способствуют бодрствованию. PT в стволе мозга также является важным компонентом ARAS. Активность холинергических нейронов PT (REM-on клетки) способствует быстрому сну. Во время бодрствования REM-клетки подавляются подмножеством ARAS норэпинефрина и серотониновых нейронов, называемых REM-off клетками.
- ^ Брудзынский С.М. (июль 2014 г.). «Восходящая мезолимбическая холинергическая система - специфический отдел ретикулярной активирующей системы, участвующий в инициации негативных эмоциональных состояний». Журнал молекулярной неврологии. 53 (3): 436–45. Дои:10.1007 / s12031-013-0179-1. PMID 24272957. S2CID 14615039.
Понимание пробуждающих и поддерживающих бодрствование функций ARAS еще больше осложнилось нейрохимическими открытиями многочисленных групп нейронов с восходящими путями, берущими свое начало в ретикулярном ядре ствола мозга, включая понтомезэнцефалические ядра, которые синтезируют различные передатчики и высвобождают их в обширных областях мозга. головном мозге и во всем неокортексе (см. обзор Jones 2003; Lin et al. 2011). Они включали глутаматергическую, холинергическую, норадренергическую, дофаминергическую, серотонинергическую, гистаминергическую и орексинергическую системы (для обзора см. Lin et al. 2011). ... ARAS представлял собой диффузные, неспецифические пути, которые, работая через срединную линию и интраламинарные таламические ядра, могли изменять активность всего неокортекса, и, таким образом, эта система была первоначально предложена как общая система возбуждения для естественных стимулов и критическая система, лежащая в основе бодрствование (Моруцци и Магун 1949; Линдсли и др. 1949; Старзл и др. 1951, см. пунктирную область на рис. 1). ... В ходе недавнего исследования на крысах было обнаружено, что состояние бодрствования в основном поддерживается восходящей глутаматергической проекцией из парабрахиального ядра и областей прекерулеуса на базальный передний мозг, а затем передается в кору головного мозга (Fuller et al. ). ... Анатомические исследования показали два основных пути, участвующих в возбуждении и исходящих из областей с группами холинергических клеток, один через таламус, а другой, проходящий вентрально через гипоталамус и преоптическую область и реципрокно связанные с лимбической системой (Nauta и Kuypers 1958; Siegel 2004). ... По подсчетам холинергических связей с ретикулярным ядром таламуса ...
- ^ Schwartz MD, Kilduff TS (декабрь 2015 г.). «Нейробиология сна и бодрствования». Психиатрические клиники Северной Америки. 38 (4): 615–44. Дои:10.1016 / j.psc.2015.07.002. ЧВК 4660253. PMID 26600100.
Эта восходящая ретикулярная активирующая система (ARAS) состоит из холинергического латеродорсального и педункулопонтинного покрытий (LDT / PPT), норадренергического голубого пятна (LC), серотонинергических (5-HT) ядер Raphe и дофаминергической вентральной тегментальной области (SN). ) и периакведуктальные серые проекции, которые стимулируют кору прямо или косвенно через таламус, гипоталамус и BF.6, 12-18 Эти аминергические и катехоламинергические популяции имеют многочисленные взаимосвязи и параллельные проекции, которые, вероятно, придают системе функциональную избыточность и устойчивость.6, 13, 19 ... Совсем недавно на основе анатомических, электрофизиологических, химио- и оптогенетических исследований медуллярная парафациальная зона (PZ), прилегающая к лицевому нерву, была идентифицирована как центр, способствующий засыпанию.23, 24 ГАМКергические нейроны PZ ингибируют глутаматергические парабрахиальные (PB) нейроны, которые проецируются в BF,25 тем самым способствуя быстрому сну за счет бодрствования и быстрого сна. ... Нейроны Hcrt широко распространяются по всему головному и спинному мозгу92, 96, 99, 100 включая основные проекции на группы клеток, способствующих бодрствованию, такие как клетки НА ТМ,101 5-HT клетки дорсальных ядер Raphe (DRN),101 норадренергические клетки ЖК,102 и холинергические клетки в LDT, PPT и BF.101, 103 ... Hcrt напрямую возбуждает клеточные системы, участвующие в пробуждении и возбуждении, включая LC,102, 106, 107 DRN,108, 109 ТМ,110-112 LDT,113, 114 холинергический БФ,115 и нейроны как дофамина (DA), так и не-DA в VTA.116, 117
- ^ Макс ДТ (май 2010 г.). «Тайны сна». Журнал National Geographic.
- ^ Крюгер Дж. М., Ректор Д. М., Рой С., Ван Донген Х. П., Беленький Г., Панксепп Дж. (Декабрь 2008 г.). «Сон как фундаментальное свойство нейронных сборок». Обзоры природы. Неврология. 9 (12): 910–9. Дои:10.1038 / номер 2521. ЧВК 2586424. PMID 18985047.
- ^ Вольстенхолм Г.Е., О'Коннор М (1961). Симпозиум Ciba Foundation по природе сна. Бостон: Маленький, Браун. ISBN 978-0-470-71922-0.
- ^ "Программа сна. Б. Филогения сна". Общество исследования сна, Комитет по образованию. Архивировано из оригинал на 2005-03-18. Получено 26 сентября 2010.
- ^ «Функция сна».. Scribd.com. Проверено 1 декабря 2011 г.
- ^ Крюгер JM, Obál F, Fang J (июнь 1999 г.). «Почему мы спим: теоретический взгляд на функцию сна». Отзывы о медицине сна. 3 (2): 119–29. Дои:10.1016 / S1087-0792 (99) 90019-9. PMID 15310481.
- ^ Крюгер JM, Obál F (июнь 1993 г.). "Теория нейронных групп функции сна". Журнал исследований сна. 2 (2): 63–69. Дои:10.1111 / j.1365-2869.1993.tb00064.x. PMID 10607073.
- ^ Медик Г, Вилле М, Хемельс МЭ (19 мая 2017 г.). «Краткосрочные и долгосрочные последствия нарушения сна для здоровья». Природа и наука сна. 9: 151–161. Дои:10.2147 / nss.s134864. ЧВК 5449130. PMID 28579842.
- ^ Чой, Чарльз К. (25 августа, 2009 г.) Новые вопросы теории, почему мы спим, LiveScience.com.
- ^ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O'Donnell J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M (октябрь 2013 г.). «Сон стимулирует выведение метаболитов из мозга взрослого человека». Наука. 342 (6156): 373–7. Bibcode:2013Наука ... 342..373X. Дои:10.1126 / science.1241224. ЧВК 3880190. PMID 24136970.
- ^ а б c Недергаард М, Голдман С.А. (2016). "Утечка мозгов". Scientific American. 314 (Март): 44–49. Bibcode:2016SciAm.314c..44N. Дои:10.1038 / scientificamerican0316-44. ЧВК 5347443. PMID 27066643.
- ^ а б Strazielle N, Ghersi-Egea JF (май 2013 г.). «Физиология интерфейсов кровь-мозг в отношении расположения в мозге малых соединений и макромолекул». Молекулярная фармацевтика. 10 (5): 1473–91. Дои:10.1021 / mp300518e. PMID 23298398.
- ^ Gümüştekín K, Seven B, Karabulut N, Aktaş O, Gürsan N, Aslan S, Keleş M, Varoglu E, Dane S (ноябрь 2004 г.). «Влияние лишения сна, никотина и селена на заживление ран у крыс». Международный журнал неврологии (Представлена рукопись). 114 (11): 1433–42. Дои:10.1080/00207450490509168. PMID 15636354. S2CID 30346608.
- ^ Загер А., Андерсен М.Л., Руис Ф.С., Антунес И.Б., Туфик С. (июль 2007 г.). «Влияние острой и хронической потери сна на иммунную модуляцию крыс». Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология. 293 (1): R504–9. Дои:10.1152 / ajpregu.00105.2007. PMID 17409265.
- ^ Opp MR (январь 2009 г.). «Сон для подпитки иммунной системы: сон млекопитающих и устойчивость к паразитам». BMC Эволюционная биология. 9: 8. Дои:10.1186/1471-2148-9-8. ЧВК 2633283. PMID 19134176.
- ^ Перес, Джуди (14 марта 2012 г.) Хорошая причина получить свой ззз Chicago Tribune Health, получено 26 марта 2014 г.
- ^ Дженни О.Г., Молинари Л., Кафлиш Дж. А., Ларго Р. Х. (октябрь 2007 г.). «Продолжительность сна от 1 года до 10 лет: изменчивость и стабильность по сравнению с ростом». Педиатрия. 120 (4): e769–76. Дои:10.1542 / педс.2006-3300. PMID 17908734. S2CID 16754966.
- ^ «Мозг может выводить токсины во время сна». Национальные институты здоровья. Получено 25 октября 2013.
- ^ Сигел Дж. М. (октябрь 2005 г.). «Ключи к функциям сна млекопитающих». Природа. 437 (7063): 1264–71. Bibcode:2005Натура.437.1264S. Дои:10.1038 / природа04285. PMID 16251951. S2CID 234089.
- ^ а б Чирелли С., Тонони Дж. (Август 2013 г.). «Возможно чернослив». Scientific American. 309 (2): 34–39. Bibcode:2013SciAm.309b..34T. Дои:10.1038 / scientificamerican0813-34. PMID 23923204.
- ^ Леви А.Дж., Вер Т.А., Гудвин Ф.К., Ньюсом Д.А., Марки С.П. (декабрь 1980 г.). «Свет подавляет секрецию мелатонина у человека». Наука. 210 (4475): 1267–9. Bibcode:1980Sci ... 210.1267L. Дои:10.1126 / science.7434030. PMID 7434030.
- ^ Leproult R, Colecchia EF, L'Hermite-Balériaux M, Van Cauter E (январь 2001 г.). «Переход от тусклого к яркому свету по утрам вызывает немедленное повышение уровня кортизола». Журнал клинической эндокринологии и метаболизма. 86 (1): 151–7. Дои:10.1210 / jcem.86.1.7102. PMID 11231993.
- ^ Ван Каутер Е., Керкхофс М., Кауфриз А., Ван Ондерберген А., Торнер М. О., Копински Г. (июнь 1992 г.). «Количественная оценка секреции гормона роста у нормального человека: воспроизводимость и отношение ко сну и времени суток». Журнал клинической эндокринологии и метаболизма. 74 (6): 1441–50. Дои:10.1210 / jcem.74.6.1592892. PMID 1592892.
- ^ Керн В., Додт С., Борн Дж., Фем Х.Л. (январь 1996 г.). «Изменения секреции кортизола и гормона роста во время ночного сна в процессе старения». Журналы геронтологии. Серия A, Биологические и медицинские науки. 51 (1): M3–9. Дои:10.1093 / gerona / 51A.1.M3. PMID 8548511.
- ^ а б Knutson KL, Spiegel K, Penev P, Van Cauter E (июнь 2007 г.). «Метаболические последствия недосыпания». Отзывы о медицине сна. 11 (3): 163–78. Дои:10.1016 / j.smrv.2007.01.002. ЧВК 1991337. PMID 17442599.
- ^ Шпигель К., Лепроулт Р., Ван Каутер Э. (октябрь 1999 г.). «Влияние недосыпания на метаболические и эндокринные функции». Ланцет. 354 (9188): 1435–9. Дои:10.1016 / S0140-6736 (99) 01376-8. PMID 10543671. S2CID 3854642.
- ^ Плихал В., Родился Дж. (1997). «Влияние раннего и позднего ночного сна на декларативную и процедурную память». Журнал когнитивной неврологии. 9 (4): 534–547. Дои:10.1162 / jocn.1997.9.4.534. PMID 23968216. S2CID 3300300.
- ^ а б c d Раш Б., Бюхель С., Гайс С., Борн Дж. (2007). «Запахи во время медленного сна вызывают декларативную консолидацию памяти». Наука. 315 (5817): 1426–9. Bibcode:2007Научный ... 315.1426R. Дои:10.1126 / science.1138581. PMID 17347444. S2CID 19788434.
- ^ а б c d е Родился J, Вильгельм I (2012). «Системная консолидация памяти во время сна». Психологические исследования. 76 (2): 192–203. Дои:10.1007 / s00426-011-0335-6. ЧВК 3278619. PMID 21541757.
- ^ Дикельманн С., Родился Дж. (2010). «Функция памяти сна». Обзоры природы Неврология. 11 (2): 114–126. Дои:10.1038 / nrn2762. PMID 20046194. S2CID 1851910.
- ^ а б Раш Б. Родился Дж. (2013). «О роли сна в памяти». Физиологические обзоры. 93 (2): 681–766. Дои:10.1152 / Physrev.00032.2012. ЧВК 3768102. PMID 23589831.
- ^ а б Шрайнер Т, Раш Б (2015). «Расширение словарного запаса с помощью словесных подсказок во время сна». Кора головного мозга. 25 (11): 4169–4179. Дои:10.1093 / cercor / bhu139. PMID 24962994.
- ^ а б c Шрайнер, Раш (2017). «Благоприятная роль реактивации памяти для изучения языка во время сна: обзор» (PDF). Мозг и язык. 167: 94–105. Дои:10.1016 / j.bandl.2016.02.005. PMID 27036946. S2CID 3377186.
- ^ а б Нго Х., Мартинец Т., Родился Дж., Мёлле М. (2013). «Звуковая стимуляция медленных колебаний сна по замкнутому циклу улучшает память». Нейрон. 78 (3): 545–553. Дои:10.1016 / j.neuron.2013.03.006. PMID 23583623.
- ^ Клинцинг Дж., Куглер С., Сукадар С., Раш Б., Борн Дж., Дикельманн С. (2018). «Распознавание запаха во время медленного сна улучшает память независимо от низкого холинергического тона». Психофармакология. 235 (1): 291–299. Дои:10.1007 / s00213-017-4768-5. ЧВК 5748395. PMID 29119218.
- ^ Шрайнер Т., Доеллер С., Йенсен О., Раш Б., Штаудигл Т. (2018). «Реактивация координированной по фазе тета-фазы памяти повторяется в медленном колебательном ритме во время медленного сна». Отчеты по ячейкам. 25 (2): 296–301. Дои:10.1016 / j.celrep.2018.09.037. ЧВК 6198287. PMID 30304670.
- ^ Шрайнер Т., Гельди М., Раш Б. (2015). «Словарный запас во время сна увеличивает тета-активность во время последующего тестирования распознавания». Психофизиология. 52 (11): 1538–1543. Дои:10.1111 / psyp.12505. PMID 26235609.
- ^ Грох, С., Шрейнер, Т., Раш, Б., Хубер, Р., и Вильгельм, И. (2017). Предварительные знания необходимы для положительного эффекта целевой реактивации памяти во время сна. Научные отчеты, 7
- ^ Тонони Дж. (2011). Функция сна и синаптический гомеостаз (Конференц-разговор). Институт Аллена.
- ^ Карлсон Н.Р., Миллер Х.Л., Хет Д.С., Донахью Дж. В., Мартин Г. Н. (2010). Психология Наука о поведении, Книги по выбору. Pearson College Div. ISBN 978-0-205-76223-1.
- ^ Hock RR (2013). «Спать, наверное, мечтать…». Сорок исследований, изменивших психологию (7-е изд.). Река Аппер Сэдл, Нью-Джерси: Pearson Education. С. 42–49. ISBN 978-0-205-91839-3.
- ^ Демент W (1966). «Глава 12: Эффект лишения сновидений: необходимость в определенном количестве сновидений каждую ночь подтверждается недавними экспериментами». Брайан физиология и психология. Калифорнийский университет Press.
- ^ а б Ван Донген HP, Мэйслин Дж., Маллингтон Дж. М., Дингс Д. Ф. (март 2003 г.). «Кумулятивная стоимость дополнительного бодрствования: доза-реакция на нейроповеденческие функции и физиологию сна в результате хронического ограничения сна и полного недосыпания». Спать. 26 (2): 117–26. Дои:10.1093 / сон / 26.2.117. PMID 12683469.
- ^ Коннор Дж., Нортон Р., Ameratunga S, Робинсон Э., Сивил I, Данн Р., Бейли Дж., Джексон Р. (май 2002 г.). «Сонливость водителей и риск получения серьезных травм у водителей автомобилей: исследование случай-контроль среди населения». BMJ. 324 (7346): 1125. Дои:10.1136 / bmj.324.7346.1125. ЧВК 107904. PMID 12003884.
- ^ Лим Дж., Дингес Д.Ф. (1 мая 2008 г.). «Недосыпание и неусыпное внимание». Летопись Нью-Йоркской академии наук. 1129 (1): 305–22. Bibcode:2008НЯСА1129..305Л. Дои:10.1196 / анналы.1417.002. PMID 18591490. S2CID 14220859.
- ^ Райт К.П., Бадиа П., Майерс Б.Л., Пленцлер СК (март 1997 г.). «Комбинация яркого света и кофеина как средство противодействия нарушению бдительности и работоспособности во время длительного недосыпания». Журнал исследований сна. 6 (1): 26–35. Дои:10.1046 / j.1365-2869.1997.00022.x. PMID 9125696. S2CID 6615362.
- ^ а б Дурмер Дж. С., Дингес Д. Ф. (март 2005 г.). «Нейрокогнитивные последствия недосыпания». Семинары по неврологии. 25 (1): 117–29. CiteSeerX 10.1.1.580.1922. Дои:10.1055 / с-2005-867080. PMID 15798944.
- ^ Драммонд С.П., Гиллин Дж. К., Браун Г. Г. (июнь 2001 г.). «Повышенная церебральная реакция во время задачи с разделенным вниманием после лишения сна». Журнал исследований сна. 10 (2): 85–92. Дои:10.1046 / j.1365-2869.2001.00245.x. PMID 11422722.
- ^ ван дер Хельм Э., Гуджар Н., Уолкер депутат (март 2010 г.). «Недостаток сна мешает точному распознаванию человеческих эмоций». Спать. 33 (3): 335–42. Дои:10.1093 / сон / 33.3.335. ЧВК 2831427. PMID 20337191.
- ^ Цуно Н., Бессет А., Ричи К. (октябрь 2005 г.). «Сон и депрессия». Журнал клинической психиатрии. 66 (10): 1254–69. Дои:10.4088 / JCP.v66n1008. PMID 16259539.
- ^ Chee MW, Chuah LY (август 2008 г.). «Функциональные возможности нейровизуализации о том, как сон и недосыпание влияют на память и познание». Текущее мнение в неврологии. 21 (4): 417–23. Дои:10.1097 / WCO.0b013e3283052cf7. PMID 18607201. S2CID 15785066.
- ^ а б Аврора Р., Зак Р., Маганти Р., Ауэрбах С., Кейси К., Чоудхури С., Моргенталер Т. (2010). «Руководство по передовой практике лечения расстройства быстрого сна (RBD)». Журнал клинической медицины сна. 6 (1): 85–95. Дои:10.5664 / jcsm.27717. ЧВК 2823283. PMID 20191945.
- ^ а б Бьёрнаро Д., Тофт (2013). «Расстройство быстрого сна при болезни Паркинсона - есть ли гендерные различия?». Паркинсонизм и связанные с ним расстройства. 19 (1): 120–122. Дои:10.1016 / j.parkreldis.2012.05.027. PMID 22726815.
- ^ а б Бьёрнаро К., Дитрихс Э., Тофт М (2015). «Продольная оценка вероятного нарушения поведения во сне с быстрым движением глаз при болезни Паркинсона». Европейский журнал неврологии. 22 (8): 1242–1244. Дои:10.1111 / ene.12723. S2CID 5237488.
- ^ а б c Ван П, Винг Ю.К., Син Дж. И др. (2016). «Нарушение поведения во сне с быстрым движением глаз у пациентов с вероятной болезнью Альцгеймера». Старение Clin Exp Res. 28 (5): 951. Дои:10.1007 / s40520-015-0382-8. PMID 26022447. S2CID 29014852.
- ^ а б c d Маккартер С., Хауэлл Дж. (2017). «Расстройство поведения во сне в фазе быстрого сна и другие нарушения сна при деменции, не связанной с болезнью Альцгеймера». Текущие отчеты о медицине сна. 3 (3): 193–203. Дои:10.1007 / s40675-017-0078-z. S2CID 148800517.
- ^ а б c d е ж грамм Дик-Мюльке, К. (2015). Психосоциальные исследования меняющихся взглядов человека на болезнь Альцгеймера (главный справочный источник). Херши, Пенсильвания: Справочник по медицинской информатике.
- ^ Revonsuo A (декабрь 2000 г.). «Переосмысление сновидений: эволюционная гипотеза функции сновидения». Поведенческие науки и науки о мозге. 23 (6): 877–901, обсуждение 904–1121. Дои:10.1017 / s0140525x00004015. PMID 11515147.
- ^ Монтанжеро Дж. (2000). «Более общая эволюционная гипотеза о функции сна». Поведенческие науки и науки о мозге. 23 (6): 972–973. Дои:10.1017 / s0140525x00664026.
- ^ Стикголд Р., Хобсон Дж., Фосс Р., Фосс М. (ноябрь 2001 г.). «Сон, обучение и сны: автономная обработка памяти». Наука. 294 (5544): 1052–7. Bibcode:2001Sci ... 294.1052S. Дои:10.1126 / science.1063530. PMID 11691983. S2CID 8631140.
- ^ Гринберг Р., Кац Х, Шварц В., Перлман С. (1992). «Пересмотр психоаналитической теории сновидений на основе исследований». Журнал Американской психоаналитической ассоциации. 40 (2): 531–50. Дои:10.1177/000306519204000211. PMID 1593084. S2CID 24985171.
- ^ Садех А., Кейнан Г., Даон К. (сентябрь 2004 г.). «Влияние стресса на сон: сдерживающая роль стиля совладания». Психология здоровья. 23 (5): 542–5. CiteSeerX 10.1.1.476.8304. Дои:10.1037/0278-6133.23.5.542. PMID 15367075.
- ^ Нильсен Т., Левин Р. (август 2007 г.). «Кошмары: новая нейрокогнитивная модель». Отзывы о медицине сна. 11 (4): 295–310. Дои:10.1016 / j.smrv.2007.03.004. PMID 17498981.
- ^ Пагель Дж. Ф. (2010). «Наркотики, сны и кошмары». Клиники медицины сна. 5 (2): 277–287. Дои:10.1016 / j.jsmc.2010.01.007.
- ^ Левин Р., Нильсен Т. (1 апреля 2009 г.). «Кошмары, дурные сны и нарушение регуляции эмоций: обзор и новая нейрокогнитивная модель сновидений». Современные направления в психологической науке. 18 (2): 84–88. Дои:10.1111 / j.1467-8721.2009.01614.x. S2CID 41082725.
