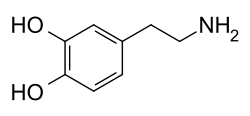
Дофамин - Dopamine
 | |
 | |
| Клинические данные | |
|---|---|
| Другие имена |
|
| Физиологический данные | |
| Источник ткани | Черная субстанция; вентральная тегментальная область; многие другие |
| Целевые ткани | Общесистемный |
| Рецепторы | D1, D2, D3, D4, D5, TAAR1[1] |
| Агонисты | Прямой: апоморфин, бромокриптин Косвенный: кокаин, амфетамин |
| Антагонисты | Нейролептики, метоклопрамид, домперидон |
| Предшественник | Фенилаланин, тирозин, и L-ДОПА |
| Биосинтез | ДОПА декарбоксилаза |
| Метаболизм | МАО, COMT[1] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.101 |
| Химические и физические данные | |
| Формула | C8ЧАС11NО2 |
| Молярная масса | 153.181 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Дофамин (DA, сокращение 3,4-dихидрохупHenethylамин) это гормон и нейротрансмиттер который играет несколько важных ролей в мозге и теле. Это органический химикат из катехоламин и фенэтиламин семьи. Дофамин составляет около 80% содержания катехоламинов в головном мозге. Это амин синтезируется удалением карбоксильная группа из молекулы его химический прекурсор L-ДОПА, который синтезированный в головном мозге и почках. Дофамин также синтезируется в растениях и большинстве животных. В мозгу дофамин функционирует как нейротрансмиттер - химическое вещество, выделяемое нейроны (нервные клетки) для передачи сигналов другим нервным клеткам. Мозг включает несколько различных дофаминовые пути, один из которых играет важную роль в мотивационной составляющей поведение, мотивированное вознаграждением. Ожидание большинства видов вознаграждений увеличивает уровень дофамина в мозгу,[2] и много вызывающий привыкание наркотики увеличить выброс дофамина или заблокировать его обратный захват в нейроны после высвобождения. Другие дофаминовые пути мозга участвуют в блок управления двигателем и в контроле высвобождения различных гормонов. Эти пути и группы ячеек образуют дофаминовую систему, которая нейромодулирующий.[нужна цитата ]
В массовой культуре и средствах массовой информации дофамин обычно считается основным химическим веществом удовольствия, но в фармакологии принято считать, что дофамин вместо этого дает мотивационная значимость;[3][4][5] Другими словами, дофамин сигнализирует о предполагаемой мотивационной значимости (т. е. о желательности или отвращении) результата, который, в свою очередь, подталкивает поведение организма к достижению этого результата или от него.[5][6]
Вне центральной нервной системы дофамин действует в первую очередь как локальный паракринный посыльный. В кровеносных сосудах подавляет норэпинефрин выпуск и действует как вазодилататор (при нормальных концентрациях); в почках увеличивает выведение натрия и диурез; в поджелудочной железе снижает выработку инсулина; в пищеварительной системе снижает перистальтика желудочно-кишечного тракта и защищает слизистая оболочка кишечника; а в иммунной системе снижает активность лимфоциты. За исключением кровеносных сосудов, дофамин в каждой из этих периферических систем синтезируется локально и оказывает свое действие вблизи клеток, которые его высвобождают.
Несколько важных заболеваний нервной системы связаны с дисфункциями дофаминовой системы, и некоторые из ключевых лекарств, используемых для их лечения, работают, изменяя эффекты дофамина. болезнь Паркинсона, дегенеративное состояние, вызывающее тремор и двигательные нарушения, вызваны потерей дофамин-секретирующих нейронов в области средний мозг называется черная субстанция. Его метаболический предшественник L-ДОПА может быть произведен; Леводопа, чистая форма L-ДОФА, является наиболее широко используемым средством лечения болезни Паркинсона. Есть свидетельства того, что шизофрения включает измененные уровни активности дофамина, и большинство антипсихотические препараты используются для лечения этого антагонисты дофамина которые снижают активность дофамина.[7] Подобные препараты-антагонисты дофамина также являются одними из самых эффективных. агенты против тошноты. Синдром беспокойных ног и Синдром дефицита внимания и гиперактивности (СДВГ) связаны со снижением активности дофамина.[8] Дофаминергический стимуляторы могут вызывать привыкание в высоких дозах, но некоторые из них используются в более низких дозах для лечения СДВГ. Дофамин сам по себе доступен как производимое лекарство для внутривенная инъекция: хотя это не может добраться до мозга из кровотока, его периферические эффекты делают его полезным при лечении сердечная недостаточность или же шок, особенно у новорожденных.
Структура
Молекула дофамина состоит из катехол структура (а бензол кольцо с двумя гидроксил боковые группы) с одним амин группа, прикрепленная через этил цепь.[9] Таким образом, дофамин - самый простой из возможных катехоламин, семья, в которую также входят нейротрансмиттеры норэпинефрин и адреналин.[10] Наличие бензольного кольца с этим аминовым присоединением делает его замещенный фенэтиламин, семья, в которую входят многочисленные психоактивные препараты.[11]
Как и большинство аминов, дофамин органическая основа.[12] Как основание, это обычно протонированный в кислый среды (в кислотно-основная реакция ).[12] Протонированная форма хорошо растворима в воде и относительно стабильна, но может становиться окисленный при воздействии кислорода или других окислители.[12] В основных средах дофамин не протонируется.[12] В этом бесплатная база форма, он менее растворим в воде, а также более активен.[12] Из-за повышенной стабильности и водорастворимости протонированной формы дофамин поставляется для химического или фармацевтического использования в виде дофамина. гидрохлорид -это гидрохлорид соль который создается, когда дофамин сочетается с соляная кислота.[12] В сухой форме гидрохлорид дофамина представляет собой мелкий порошок от белого до желтого цвета.[13]
Биохимия
Синтез
Дофамин синтезированный в ограниченном наборе типов клеток, в основном нейронах и клетках мозговое вещество из надпочечники.[17] Первичный и второстепенный метаболические пути соответственно:
- Начальный: L-Фенилаланин → L-Тирозин → L-ДОПА → Дофамин[14][15]
- Незначительный: L-Фенилаланин → L-Тирозин → п-Тирамин → Дофамин[14][15][16]
- Незначительный: L-Фенилаланин → м-Тирозин → м-Тирамин → Дофамин[16][18][19]
Прямой предшественник дофамина, L-ДОПА, могут быть синтезированы косвенно из незаменимая аминокислота фенилаланин или непосредственно из незаменимой аминокислоты тирозин.[20] Эти аминокислоты содержатся почти в каждом белке и поэтому легко доступны в пище, причем тирозин является наиболее распространенным. Хотя дофамин также содержится во многих продуктах питания, он не может пересекать гематоэнцефалический барьер что окружает и защищает мозг.[21] Следовательно, он должен синтезироваться внутри мозга, чтобы выполнять свои функции. нейронная активность.[21]
L-Фенилаланин превращается в L-тирозин фермент фенилаланингидроксилаза, с молекулярный кислород (O2) и тетрагидробиоптерин в качестве кофакторы. L-Тирозин превращается в L-Дофа ферментом тирозингидроксилаза, с тетрагидробиоптерином, O2, и железо (Fe2+) как кофакторы.[20] L-Дофа превращается в дофамин ферментом ароматный Lдекарбоксилаза аминокислот (также известная как DOPA декарбоксилаза), с пиридоксальфосфат в качестве кофактора.[20]
Сам дофамин используется в качестве предшественника в синтезе нейромедиаторов норадреналина и адреналина.[20] Дофамин превращается в норэпинефрин ферментом дофамин-β-гидроксилаза, с O2 и L-аскорбиновая кислота как кофакторы.[20] Норэпинефрин превращается в адреналин под действием фермента фенилэтаноламин N-метилтрансфераза с S-аденозил-L-метионин в качестве кофактора.[20]
Некоторые кофакторы также требуют собственного синтеза.[20] Дефицит какой-либо необходимой аминокислоты или кофактора может нарушить синтез дофамина, норэпинефрина и адреналина.[20]
Деградация
Дофамин расщепляется на неактивные метаболиты набором ферментов -моноаминоксидаза (МАО), катехолО-метилтрансфераза (COMT) и альдегиддегидрогеназа (ALDH), действуя последовательно.[22] Обе изоформы моноаминоксидазы, МАО-А и МАО-Б, эффективно метаболизируют дофамин.[20] Существуют разные пути разрушения, но основным конечным продуктом является гомованиловая кислота (HVA), биологическая активность которого неизвестна.[22] Из кровотока гомованилловая кислота отфильтровывается почками, а затем выводится с мочой.[22] Двумя основными метаболическими путями, которые превращают дофамин в HVA, являются:
- Дофамин → ДОПАЛ → ДОПАК → HVA - катализируется MAO, ALDH и COMT соответственно
- Дофамин → 3-метокситирамин → HVA - катализируется COMT и MAO + ALDH соответственно
В клинических исследованиях шизофрении определение гомованиллиновой кислоты в плазма были использованы для оценки уровня активности дофамина в головном мозге. Однако сложность этого подхода состоит в том, чтобы выделить высокий уровень гомованилловой кислоты в плазме, обусловленный метаболизмом норадреналина.[23][24]
Хотя дофамин обычно расщепляется оксидоредуктаза фермент, он также подвержен окислению путем прямой реакции с кислородом, давая хиноны плюс различные свободные радикалы как продукты.[25] Скорость окисления может быть увеличена за счет присутствия железо железо или другие факторы. Хиноны и свободные радикалы, образующиеся при автоокислении дофамина, могут ядовитые клетки, и есть свидетельства того, что этот механизм может способствовать потере клеток, происходящей в болезнь Паркинсона и другие условия.[26]
Функции
Клеточные эффекты
| Семья | Рецептор | Ген | Тип | Механизм |
|---|---|---|---|---|
| D1-подобный | D1 | DRD1 | граммs -сопряженный. | Повышают внутриклеточные уровни лагерь путем активации аденилатциклаза. |
| D5 | DRD5 | |||
| D2-подобный | D2 | DRD2 | граммя -сопряженный. | Снижают внутриклеточные уровни лагерь подавляя аденилатциклаза. |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| ТААР | TAAR1 | TAAR1 | граммs -сопряженный. граммq -сопряженный. | Повышают внутриклеточные уровни лагерь и внутриклеточная концентрация кальция. |
Дофамин оказывает свое действие путем связывания и активации рецепторы клеточной поверхности.[17] У людей дофамин имеет высокий сродство связывания в дофаминовые рецепторы и человеческий следовой амин-ассоциированный рецептор 1 (hTAAR1).[1][27] У млекопитающих пять подтипов дофаминовые рецепторы были идентифицированы, помечены от D1 до D5.[17] Все они функционируют как метаботропный, G-белковые рецепторы, что означает, что они оказывают свое влияние через сложную вторая система обмена сообщениями.[28] Эти рецепторы можно разделить на два семейства, известных как D1-подобный и D2-подобный.[17] Для рецепторов, расположенных на нейронах нервной системы, конечным эффектом D1-подобной активации (D1 и D5) может быть возбуждение (через открытие натриевые каналы ) или запрета (через открытие калиевые каналы ); конечным эффектом D2-подобной активации (D2, D3 и D4) обычно является ингибирование целевого нейрона.[28] Следовательно, неправильно описывать дофамин как возбуждающий или тормозящий: его действие на нейрон-мишень зависит от того, какие типы рецепторов присутствуют на мембране этого нейрона, и от внутренних ответов этого нейрона на второго мессенджера. лагерь.[28] Рецепторы D1 - самые многочисленные рецепторы допамина в нервной системе человека; Следующими идут рецепторы D2; Рецепторы D3, D4 и D5 присутствуют на значительно более низких уровнях.[28]
Хранение, выпуск и обратный захват
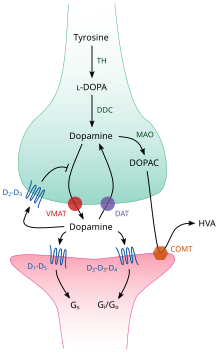
TH: тирозингидроксилаза
ДОПА: L-ДОПА
DAT: переносчик дофамина
DDC: ДОПА декарбоксилаза
VMAT: везикулярный переносчик моноаминов 2
МАО: Моноаминоксидаза
COMT: Катехол-О-метилтрансфераза
HVA: Гомованиловая кислота
Внутри мозга дофамин действует как нейротрансмиттер и нейромодулятор, и управляется набором механизмов, общих для всех моноаминовые нейротрансмиттеры.[17] После синтеза дофамин транспортируется из цитозоль в синаптические везикулы по носитель растворенного вещества —А везикулярный переносчик моноаминов, VMAT2.[29] Дофамин хранится в этих пузырьках до тех пор, пока не попадет в синаптическая щель. В большинстве случаев высвобождение дофамина происходит в процессе, называемом экзоцитоз что вызвано потенциалы действия, но это также может быть вызвано активностью внутриклеточного следовые аминосвязанные рецепторы, TAAR1.[27] TAAR1 представляет собой рецептор с высоким сродством к дофамину, следы аминов, и некоторые замещенные амфетамины который расположен вдоль мембран во внутриклеточной среде пресинаптической клетки;[27] активация рецептора может регулировать передачу сигналов дофамина, индуцируя дофамин ингибирование обратного захвата и излияние а также путем подавления возбуждения нейронов с помощью разнообразного набора механизмов.[27][30]
Попадая в синапс, дофамин связывается и активирует дофаминовые рецепторы.[31] Это может быть постсинаптический рецепторы дофамина, которые расположены на дендриты (постсинаптический нейрон) или пресинаптический ауторецепторы (например, D2ш и пресинаптический D3 рецепторы), которые расположены на мембране терминал аксона (пресинаптический нейрон).[17][31] После того, как постсинаптический нейрон вызывает потенциал действия, молекулы дофамина быстро освобождаются от своих рецепторов. Затем они всасываются обратно в пресинаптическую клетку через обратный захват при посредничестве либо переносчик дофамина или переносчик моноаминов плазматической мембраны.[32] Вернувшись в цитозоль, дофамин может быть расщеплен моноаминоксидаза или переупакован в пузырьки с помощью VMAT2, чтобы сделать его доступным для будущего выпуска.[29]
В головном мозге уровень внеклеточного дофамина регулируется двумя механизмами: фазическая и тоническая передача.[33] Высвобождение фазового дофамина, как и высвобождение большинства нейромедиаторов в нервной системе, напрямую зависит от потенциалов действия в дофаминсодержащих клетках.[33] Тоническая передача дофамина происходит, когда небольшое количество дофамина высвобождается без предсинаптических потенциалов действия.[33] Тоническая передача регулируется множеством факторов, включая активность других нейронов и обратный захват нейротрансмиттера.[33]
Нервная система

Внутри мозга дофамин играет важную роль в исполнительные функции, блок управления двигателем, мотивация, возбуждение, подкрепление, и награда, а также функции нижнего уровня, включая кормление грудью, сексуальное удовлетворение, и тошнота. В группы дофаминергических клеток и пути составляют дофаминовую систему, которая нейромодулирующий.
Дофаминергический нейронов (нервных клеток, продуцирующих дофамин) сравнительно мало - всего около 400000 в головном мозге человека.[34]-и их клеточные тела ограничены группами в нескольких относительно небольших областях мозга.[35] Однако их аксоны проецируются на многие другие области мозга и оказывают мощное воздействие на свои цели.[35] Эти группы дофаминергических клеток были впервые нанесены на карту в 1964 г. Анника Дальстрём и Kjell Fuxe, который присвоил им ярлыки, начинающиеся с буквы «A» (от «аминергический»).[36] На их схеме области с A1 по A7 содержат нейротрансмиттер норадреналин, а области с A8 по A14 содержат дофамин. Они идентифицировали дофаминергические области: черная субстанция (группы 8 и 9); то вентральная тегментальная область (группа 10); задний гипоталамус (группа 11); то дугообразное ядро (группа 12); то Zona Incerta (группа 13) и перивентрикулярное ядро (группа 14).[36]
Черная субстанция - это небольшая область среднего мозга, которая образует компонент базальный ганглий. Он состоит из двух частей - области ввода, называемой pars compacta и область вывода pars reticulata. Дофаминергические нейроны обнаруживаются в основном в компактной части (группа клеток A8) и поблизости (группа A9).[35] У людей проекция дофаминергических нейронов из компактной части черной субстанции в дорсальное полосатое тело, называемая нигростриальный путь, играет важную роль в контроле двигательной функции и в изучении новых двигательные навыки.[37] Эти нейроны особенно уязвимы для повреждения, и когда большое количество из них умирает, в результате возникает паркинсонический синдром.[38]
В вентральная тегментальная область (VTA) - еще одна область среднего мозга. Наиболее известная группа дофаминергических нейронов VTA проецируется в префронтальную кору через мезокортикальный путь и другая меньшая группа проецируется на прилежащее ядро через мезолимбический путь. Вместе эти два пути называются мезокортиколимбическая проекция.[35][37] VTA также отправляет дофаминергические прогнозы в миндалина, поясная извилина, гиппокамп, и обонятельная луковица.[35][37] Мезокортиколимбические нейроны играют центральную роль в вознаграждении и других аспектах мотивации.[37] Накапливающаяся литература показывает, что дофамин также играет решающую роль в аверсивном обучении благодаря его воздействию на ряд областей мозга.[39][40][41]
В заднем гипоталамусе есть дофаминовые нейроны, которые проецируются в спинной мозг, но их функция не установлена.[42] Есть некоторые свидетельства того, что патология в этой области играет роль в синдроме беспокойных ног - состоянии, при котором люди испытывают трудности со сном из-за непреодолимого принуждения к постоянному движению частей тела, особенно ног.[42]
В дугообразном ядре и перивентрикулярном ядре гипоталамуса есть дофаминовые нейроны, которые образуют важную проекцию - тубероинфундибулярный путь который идет в гипофиз, где он влияет на секрецию гормона пролактин.[43] Дофамин является основным нейроэндокринный ингибитор секреции пролактин от передний гипофиз железа.[43] Дофамин, продуцируемый нейронами дугообразного ядра, секретируется в гипофизарная портальная система из срединное возвышение, который поставляет гипофиз.[43] В пролактиновые клетки которые продуцируют пролактин, в отсутствие дофамина, непрерывно секретируют пролактин; дофамин подавляет эту секрецию.[43] В контексте регулирования секреции пролактина дофамин иногда называют фактором, ингибирующим пролактин, гормоном, ингибирующим пролактин, или пролактостатином.[43]
Зона инцерта, сгруппированная между дугообразным и перивентрикулярным ядрами, проецируется на несколько областей гипоталамуса и участвует в контроле гонадотропин-рилизинг гормон, что необходимо для активизации развития мужчина и женские репродуктивные системы, после полового созревания.[43]
Дополнительная группа нейронов, секретирующих дофамин, находится в сетчатка глаза.[44] Эти нейроны амакриновые клетки, что означает, что у них нет аксонов.[44] Они выделяют дофамин во внеклеточную среду и особенно активны в дневное время, а ночью замолкают.[44] Этот дофамин сетчатки усиливает активность конические клетки в сетчатке при подавлении стержневые клетки - в результате повышается чувствительность к цвету и контрасту в условиях яркого освещения за счет снижения чувствительности при тусклом свете.[44]
Базальный ганглий

Крупнейшими и наиболее важными источниками дофамина в головном мозге позвоночных являются черная субстанция и вентральная область покрышки.[35] Эти структуры тесно связаны между собой и во многом схожи функционально.[35] Оба являются компонентами среднего мозга.[35] Самый крупный компонент базальных ганглиев - полосатое тело.[45] Черная субстанция посылает дофаминергическую проекцию на спинное полосатое тело, в то время как вентральная тегментальная область посылает аналогичный тип дофаминергической проекции на брюшное полосатое тело.[35]
Прогресс в понимании функций базальных ганглиев был медленным.[45] Наиболее популярные гипотезы в широком смысле предполагают, что базальные ганглии играют центральную роль в выбор действия.[46] Теория выбора действия в своей простейшей форме предполагает, что, когда человек или животное находятся в ситуации, когда возможны несколько вариантов поведения, активность базальных ганглиев определяет, какое из них выполняется, освобождая эту реакцию от торможения, продолжая подавлять другие двигательные системы что при активации вызовет конкурирующее поведение.[47] Таким образом, в этой концепции базальные ганглии несут ответственность за инициирование поведения, но не за определение деталей того, как оно осуществляется. Другими словами, они, по сути, образуют систему принятия решений.[47]
Базальные ганглии можно разделить на несколько секторов, каждый из которых участвует в управлении определенными типами действий.[48] Вентральный сектор базальных ганглиев (содержащий вентральное полосатое тело и вентральную тегментальную область) работает на самом высоком уровне иерархии, выбирая действия на уровне всего организма.[47] Дорсальные секторы (содержащие спинное полосатое тело и черную субстанцию) работают на более низких уровнях, выбирая определенные мышцы и движения, которые используются для реализации заданного паттерна поведения.[48]
Дофамин участвует в процессе выбора действия по крайней мере двумя важными способами. Во-первых, он устанавливает «порог» для инициирования действий.[46] Чем выше уровень активности дофамина, тем ниже импульс, необходимый для того, чтобы вызвать определенное поведение.[46] Как следствие, высокий уровень дофамина приводит к высокой двигательной активности и импульсивное поведение; низкий уровень дофамина приводит к оцепенение и замедленные реакции.[46] Болезнь Паркинсона, при которой уровни дофамина в цепи черной субстанции значительно снижены, характеризуется ригидностью и затруднением начала движения, однако, когда люди с этим заболеванием сталкиваются с сильными раздражителями, такими как серьезная угроза, их реакции могут быть столь же энергичными, как и у здорового человека.[49] В противоположном направлении препараты, которые увеличивают высвобождение дофамина, такие как кокаин или амфетамин, могут вызывать повышенный уровень активности, в том числе, в крайних случаях, психомоторное возбуждение и стереотипные движения.[50]
Второй важный эффект дофамина - это «обучающий» сигнал.[46] Когда действие сопровождается увеличением активности дофамина, цепь базальных ганглиев изменяется таким образом, что легче вызывать такую же реакцию, когда в будущем возникают подобные ситуации.[46] Это форма оперантного кондиционирования, в котором дофамин играет роль сигнала вознаграждения.[47]
Награда

На языке, который используется для обсуждения системы вознаграждения, награда привлекательное и мотивирующее свойство стимула, вызывающего аппетитное поведение (также известное как подходящее поведение) и совершенное поведение.[51] Вознаграждающий стимул - это стимул, который может побудить организм приблизиться к нему и принять его.[51] Удовольствие, учусь (например., классический и оперантного кондиционирования ) и подходящее поведение - три основные функции вознаграждения.[51] В качестве награды удовольствие дает определение вознаграждения;[51] однако, хотя все приятные стимулы приносят удовлетворение, не все стимулирующие стимулы доставляют удовольствие (например, внешние награды, такие как деньги).[51][52] Мотивационный или желательный аспект поощрения стимулов отражается подходящим поведением, которое они вызывают, в то время как удовольствие от внутренних поощрений возникает в результате их потребления после их получения.[51] Нейропсихологическая модель, которая различает эти два компонента стимула, приносящего внутреннее удовлетворение, - это стимулирующая значимость модель, в которой «желание» или «желание» (реже «ищущий»[53]) соответствует аппетитному или подходящему поведению, в то время как «симпатия» или удовольствие соответствует завершающемуся поведению.[51][3][54] В человеческом наркоманы, «желание» расщепляется с «симпатией» по мере того, как увеличивается желание употреблять вызывающий привыкание наркотик, в то время как удовольствие, получаемое от его употребления, уменьшается из-за переносимость лекарств.[3]
В мозге дофамин частично выступает в качестве глобального сигнала вознаграждения. Первоначальный дофаминовый ответ на полезный стимул кодирует информацию о заметность, значение и контекст награды.[51] В контексте обучения, связанного с вознаграждением, дофамин также действует как ошибка предсказания вознаграждения signal, то есть степень неожиданности ценности вознаграждения.[51] Согласно этой гипотезе Вольфрам Шульц, ожидаемые вознаграждения не вызывают второй фазовой дофаминовой реакции в определенных дофаминергических клетках, но неожиданные или большие, чем ожидалось, вознаграждения вызывают кратковременное повышение синаптического дофамина, тогда как пропуск ожидаемого вознаграждения фактически вызывает выброс дофамина. опуститься ниже фонового уровня.[51] Гипотеза "ошибки предсказания" вызвала особый интерес у компьютерных нейробиологов, потому что влиятельный метод вычислительного обучения, известный как обучение разнице во времени активно использует сигнал, кодирующий ошибку предсказания.[51] Это слияние теории и данных привело к плодотворному взаимодействию между нейробиологами и компьютерными учеными, заинтересованными в машинное обучение.[51]
Свидетельства из микроэлектрод записи мозга животных показывают, что дофаминовые нейроны в вентральной тегментальной области (VTA) и черной субстанции сильно активируются широким спектром полезных событий.[51] Эти реагирующие на вознаграждение дофаминовые нейроны в VTA и черной субстанции имеют решающее значение для познания, связанного с вознаграждением, и служат центральным компонентом системы вознаграждения.[3][55][56] Функция дофамина варьируется в зависимости от аксональная проекция от ВТА и черной субстанции;[3] например, VTA–оболочка прилежащего ядра проекция придает значимость стимула («желание») поощрительным стимулам и связанным с ними реплики, VTA–орбитофронтальная кора проекция обновляет ценность различных целей в соответствии с их стимулирующей значимостью, проекции VTA – миндалевидное тело и VTA – гиппокамп опосредуют консолидацию воспоминаний, связанных с вознаграждением, и оба прогноза VTA–ядро прилежащего ядра и пути черная субстанция - дорсальное полосатое тело участвуют в обучении двигательных реакциях, которые облегчают приобретение полезных стимулов.[3][57] Некоторая активность в дофаминергических проекциях VTA, по-видимому, также связана с предсказанием вознаграждения.[3][57]
Удовольствие
В то время как дофамин играет центральную роль в возникновении «желания», связанного с аппетитами или поведенческими реакциями приближения на поощрительные стимулы, подробные исследования показали, что дофамин нельзя просто отождествлять с гедоническим «симпатией» или удовольствием, что отражается в окончательной поведенческой реакции.[52] Передача дофамина участвует в некоторых, но не во всех аспектах познания, связанного с удовольствием, поскольку центры удовольствия были идентифицированы как внутри дофаминовой системы (т. е. оболочки прилежащего ядра), так и вне дофаминовой системы (т. е. брюшной паллидум и парабрахиальное ядро ).[52][54][58] Например, прямая электростимуляция Работа с дофаминовыми путями с использованием электродов, имплантированных в мозг, доставляет удовольствие, и многие животные готовы работать, чтобы получить его.[59] Антипсихотические препараты снижают уровень дофамина и вызывают ангедония, снижение способности испытывать удовольствие.[60] Многие виды приятного опыта, такие как секс, еда и видеоигры, увеличивают выброс дофамина.[61] Все наркотики, вызывающие привыкание, прямо или косвенно влияют на передачу дофамина в прилежащем ядре;[3][59] эти наркотики увеличивают «желание» наркотиков, что приводит к компульсивному употреблению наркотиков, при многократном приеме в высоких дозах, предположительно через повышение значимости стимула.[54] К лекарствам, повышающим концентрацию синаптического дофамина, относятся: психостимуляторы такие как метамфетамин и кокаин. Это приводит к увеличению «желающих» поведений, но не сильно меняет выражение удовольствия или уровень насыщения.[54][59] Тем не мение, опиум такие наркотики, как героин и морфин, вызывают усиление проявлений поведения «симпатия» и «желание».[54] Более того, животные, у которых вентральная тегментальная дофаминовая система неактивна, не ищут пищи и умрут от голода, если их предоставят самим себе, но если пищу положить им в рот, они будут ее съедать и проявлять выражения, указывающие на удовольствие.[62]
Клиническое исследование, проведенное в январе 2019 г., оценивало влияние предшественника дофамина (леводопа ), антагонист дофамина (рисперидон ) и плацебо в ответах на музыку, включая степень удовольствия, полученного во время музыкальный озноб, измеряемые изменениями в электродермальная активность а также субъективные оценки - обнаружено, что манипуляции с нейротрансмиссией дофамина двунаправленно регулируют познание удовольствия (в частности, гедонистическое влияние музыки ) у людей.[63][64] Это исследование показало, что повышенная нейротрансмиссия дофамина действует как sine qua non условие приятных гедонистических реакций на музыку у людей.[63][64]
Вне нервной системы
Дофамин не проникает через гематоэнцефалический барьер, поэтому его синтез и функции в периферических областях в значительной степени не зависят от его синтеза и функций в головном мозге.[21] Значительное количество дофамина циркулирует в кровотоке, но его функции там не совсем ясны.[22] Дофамин обнаружен в плазме крови на уровнях, сопоставимых с уровнями адреналина, но у людей более 95% дофамина в плазме находится в форме дофамина. сульфат, конъюгат, продуцируемый ферментом сульфотрансфераза 1A3 / 1A4 действует на свободный дофамин.[22] Основная часть этого сульфата дофамина производится в брыжейка который окружает части пищеварительной системы.[22] Производство дофамина сульфата считается механизмом детоксикации дофамина, который попадает в организм с пищей или вырабатывается в процессе пищеварения - уровни в плазме обычно повышаются более чем в 50 раз после еды.[22] Сульфат допамина не имеет известных биологических функций и выводится с мочой.[22]
Относительно небольшое количество неконъюгированного дофамина в кровотоке может быть произведено Симпатическая нервная система, пищеварительная система или, возможно, другие органы.[22] Он может действовать на рецепторы дофамина в периферических тканях, метаболизироваться или превращаться ферментом в норэпинефрин. дофамин бета гидроксилаза, который попадает в кровоток мозговым веществом надпочечников.[22] Некоторые дофаминовые рецепторы расположены в стенках артерий, где они действуют как вазодилататор и ингибитор высвобождения норэпинефрина.[65] Эти реакции могут быть активированы дофамином, высвобождаемым из сонная артерия в условиях низкого содержания кислорода, но неизвестно, выполняют ли артериальные дофаминовые рецепторы другие биологически полезные функции.[65]
Помимо своей роли в модуляции кровотока, существует несколько периферических систем, в которых дофамин циркулирует в ограниченной области и выполняет экзокринный или же паракринный функция.[22] Периферические системы, в которых дофамин играет важную роль, включают: иммунная система, то почки и поджелудочная железа.
В иммунной системе дофамин действует на рецепторы иммунных клеток, особенно лимфоциты.[66] Дофамин также может влиять на иммунные клетки в селезенка, Костный мозг, и сердечно-сосудистая система.[67] Кроме того, дофамин может синтезироваться и высвобождаться самими иммунными клетками.[66] Основное действие дофамина на лимфоциты - снижение уровня их активации. Функциональное значение этой системы неясно, но она представляет собой возможный путь взаимодействия между нервной системой и иммунной системой и может иметь отношение к некоторым аутоиммунным заболеваниям.[67]
Почечная дофаминергическая система расположена в клетках нефрон в почках, где присутствуют все подтипы дофаминовых рецепторов.[68] Здесь также синтезируется дофамин. трубочка ячеек, и разряжен в трубчатая жидкость. Его действия включают увеличение кровоснабжения почек, увеличение скорость клубочковой фильтрации, и увеличение выведения натрия с мочой. Следовательно, дефекты функции дофамина в почках могут привести к снижению выведения натрия и, как следствие, к развитию высокое кровяное давление. Существуют убедительные доказательства того, что сбои в производстве дофамина или в рецепторах могут привести к ряду патологий, включая окислительный стресс, отек, а также генетическая или эссенциальная гипертензия. Окислительный стресс сам по себе может вызвать гипертонию.[69] Дефекты в системе также могут быть вызваны генетическими факторами или высоким кровяным давлением.[70]
В поджелудочной железе роль дофамина несколько сложна. Поджелудочная железа состоит из двух частей: экзокринный и эндокринный компонент. Экзокринная часть синтезирует и секретирует пищеварительные ферменты и другие вещества, включая дофамин, попадают в тонкий кишечник.[71] Функция этого секретируемого дофамина после того, как он попадает в тонкий кишечник, четко не установлена - возможности включают защиту слизистой оболочки кишечника от повреждений и уменьшение перистальтика желудочно-кишечного тракта (скорость, с которой содержимое проходит через пищеварительную систему).[71]
Островки поджелудочной железы составляют эндокринную часть поджелудочной железы и синтезируют и секретируют гормоны, включая инсулин в кровоток.[71] Есть свидетельства того, что бета-клетки в островках, которые синтезируют инсулин, содержатся рецепторы дофамина, и этот допамин действует, уменьшая количество выделяемого ими инсулина.[71] Источник их поступления дофамина точно не установлен - он может поступать от дофамина, который циркулирует в кровотоке и поступает из симпатической нервной системы, или он может синтезироваться локально другими типами клеток поджелудочной железы.[71]
Медицинское использование

Дофамин как производимый медикамент продается под торговыми названиями Intropin, Dopastat и Revimine, среди прочих. Это на Список основных лекарственных средств Всемирной организации здравоохранения.[72] Чаще всего он используется в качестве стимулирующего препарата при лечении тяжелых низкое кровяное давление, медленный пульс, и остановка сердца. Это особенно важно при их лечении в новорожденные младенцы.[73] Его вводят внутривенно. Поскольку период полувыведения дофамина в плазме очень короткий - примерно одна минута у взрослых, две минуты у новорожденных и до пяти минут у недоношенных детей, его обычно вводят непрерывно внутривенно, а не однократно.[74]
Его эффекты, в зависимости от дозировки, включают увеличение выведения натрия почками, увеличение диуреза, увеличение частота сердцебиения, и увеличение артериальное давление.[74] В низких дозах действует через симпатическую нервную систему, увеличивая сила сокращения сердечной мышцы и пульс, тем самым увеличивая сердечный выброс и артериальное давление.[75] Более высокие дозы также вызывают вазоконстрикция что еще больше увеличивает кровяное давление.[75][76] В более старых литературных источниках также описаны очень низкие дозы, которые, как считается, улучшают функцию почек без других последствий, но недавние обзоры пришли к выводу, что такие низкие дозы неэффективны и иногда могут быть вредными.[77] В то время как некоторые эффекты возникают в результате стимуляции дофаминовых рецепторов, заметные сердечно-сосудистые эффекты возникают в результате действия дофамина α1, β1, и β2 адренорецепторы.[78][79]
Побочные эффекты дофамина включают негативное влияние на функцию почек и нерегулярное сердцебиение.[75] В LD50, или смертельная доза, которая, как ожидается, окажется фатальной для 50% населения, составила: 59 мг / кг (мышь; вводили внутривенно ); 95 мг / кг (мышь; вводили внутрибрюшинно ); 163 мг / кг (крыса; внутрибрюшинно); 79 мг / кг (собака; внутривенно).[80]
А фторированный форма L-ДОПА, известная как фтородопа доступен для использования в позитронно-эмиссионная томография для оценки функции нигростриатного пути.[81]
Болезни, расстройства и фармакология
Система дофамина играет центральную роль в нескольких важных медицинских состояниях, включая болезнь Паркинсона, синдром дефицита внимания и гиперактивности, синдром Туретта, шизофрения, биполярное расстройство и зависимость. Помимо самого дофамина, существует множество других важных лекарств, которые действуют на дофаминовые системы в различных частях мозга или тела. Некоторые из них используются в медицинских или развлекательных целях, но нейрохимики также разработали ряд исследовательских препаратов, некоторые из которых связываются с высокой аффинностью с определенными типами дофаминовых рецепторов и либо мучиться или же противодействовать их эффекты, а также многие другие аспекты физиологии дофамина,[82] включая переносчик дофамина ингибиторы, ингибиторы VMAT и ингибиторы ферментов.
Стареющий мозг
В ряде исследований сообщалось о возрастном снижении синтеза дофамина и плотности дофаминовых рецепторов (то есть количества рецепторов) в головном мозге.[83] Было показано, что это снижение происходит в полосатом теле и экстрастриатальный регионы.[84] Снижение D1, D2, и D3 рецепторы хорошо документированы.[85][86][87] Считается, что снижение уровня дофамина с возрастом является причиной многих неврологических симптомов, которые учащаются с возрастом, таких как уменьшение размаха рук и увеличение жесткость.[88] Changes in dopamine levels may also cause age-related changes in cognitive flexibility.[88]
Other neurotransmitters, such as серотонин и глутамат also show a decline in output with aging.[87][89]
Рассеянный склероз
Studies reported that dopamine imbalance influence the fatigue in multiple sclerosis.[90] Patients with multiple sclerosis dopamine inhibits production of IL-17 and IFN-γ by peripheral blood mononuclear cells.[91]
болезнь Паркинсона
Parkinson's disease is an age-related disorder characterized by двигательные расстройства such as stiffness of the body, slowing of movement, and trembling of limbs when they are not in use.[49] In advanced stages it progresses to слабоумие and eventually death.[49] The main symptoms are caused by the loss of dopamine-secreting cells in the substantia nigra.[92] These dopamine cells are especially vulnerable to damage, and a variety of insults, including энцефалит (as depicted in the book and movie "Пробуждения "), repeated sports-related сотрясения, and some forms of chemical poisoning such as MPTP, can lead to substantial cell loss, producing a parkinsonian syndrome that is similar in its main features to Parkinson's disease.[93] Most cases of Parkinson's disease, however, are идиопатический, meaning that the cause of cell death cannot be identified.[93]
The most widely used treatment for parkinsonism is administration of L-DOPA, the metabolic precursor for dopamine.[21] L-DOPA is converted to dopamine in the brain and various parts of the body by the enzyme DOPA decarboxylase.[20] L-DOPA is used rather than dopamine itself because, unlike dopamine, it is capable of crossing the гематоэнцефалический барьер.[21] It is often co-administered with an ингибитор фермента периферийных декарбоксилирование Такие как карбидопа или же бенсеразид, to reduce the amount converted to dopamine in the periphery and thereby increase the amount of L-DOPA that enters the brain.[21] When L-DOPA is administered regularly over a long time period, a variety of unpleasant side effects such as дискинезия often begin to appear; even so, it is considered the best available long-term treatment option for most cases of Parkinson's disease.[21]
L-DOPA treatment cannot restore the dopamine cells that have been lost, but it causes the remaining cells to produce more dopamine, thereby compensating for the loss to at least some degree.[21] In advanced stages the treatment begins to fail because the cell loss is so severe that the remaining ones cannot produce enough dopamine regardless of L-DOPA levels.[21] Other drugs that enhance dopamine function, such as бромокриптин и перголид, are also sometimes used to treat Parkinsonism, but in most cases L-DOPA appears to give the best trade-off between positive effects and negative side-effects.[21]
Dopaminergic medications that are used to treat Parkinson's disease are sometimes associated with the development of a синдром дисрегуляции дофамина, which involves the overuse of dopaminergic medication and medication-induced compulsive engagement in естественные награды like gambling and sexual activity.[94][95] The latter behaviors are similar to those observed in individuals with a поведенческая зависимость.[94]
Drug addiction and psychostimulants

Кокаин, substituted amphetamines (including метамфетамин ), Adderall, метилфенидат (продается как Риталин или же Концерт ), и другие психостимуляторы exert their effects primarily or partly by increasing dopamine levels in the brain by a variety of mechanisms.[96] Cocaine and methylphenidate are dopamine transporter blockers or ингибиторы обратного захвата; Oни non-competitively inhibit dopamine reuptake, resulting in increased dopamine concentrations in the synaptic cleft.[97][98]:54–58 Like cocaine, substituted amphetamines and amphetamine also increase the concentration of dopamine in the синаптическая щель, but by different mechanisms.[30][98]:147–150
The effects of psychostimulants include increases in heart rate, body temperature, and sweating; improvements in alertness, attention, and endurance; increases in pleasure produced by rewarding events; but at higher doses agitation, anxiety, or even потеря контакта с реальностью.[96] Drugs in this group can have a high addiction potential, due to their activating effects on the dopamine-mediated reward system in the brain.[96] However some can also be useful, at lower doses, for treating attention deficit hyperactivity disorder (ADHD) and нарколепсия.[99][100] An important differentiating factor is the onset and duration of action.[96] Cocaine can take effect in seconds if it is injected or inhaled in free base form; the effects last from 5 to 90 minutes.[101] This rapid and brief action makes its effects easily perceived and consequently gives it high addiction potential.[96] Methylphenidate taken in pill form, in contrast, can take two hours to reach peak levels in the bloodstream,[99] and depending on formulation the effects can last for up to 12 hours.[102] These longer acting formulations have the benefit of reducing the potential for abuse, and improving adherence for treatment by using more convenient dosage regimens.[103]

A variety of addictive drugs produce an increase in reward-related dopamine activity.[96] Stimulants such as никотин, cocaine and methamphetamine promote increased levels of dopamine which appear to be the primary factor in causing addiction. For other addictive drugs such as the опиоид heroin, the increased levels of dopamine in the reward system may only play a minor role in addiction.[104] When people addicted to stimulants go through withdrawal, they do not experience the physical suffering associated with отмена алкоголя или же снятие from opiates; instead they experience craving, an intense desire for the drug characterized by irritability, restlessness, and other arousal symptoms,[105] вызванный психологическая зависимость.
The dopamine system plays a crucial role in several aspects of addiction. At the earliest stage, genetic differences that alter the expression of dopamine receptors in the brain can predict whether a person will find stimulants appealing or aversive.[106] Consumption of stimulants produces increases in brain dopamine levels that last from minutes to hours.[96] Finally, the chronic elevation in dopamine that comes with repetitive high-dose stimulant consumption triggers a wide-ranging set of structural changes in the brain that are responsible for the behavioral abnormalities which characterize an addiction.[107] Treatment of stimulant addiction is very difficult, because even if consumption ceases, the craving that comes with psychological withdrawal does not.[105] Even when the craving seems to be extinct, it may re-emerge when faced with stimuli that are associated with the drug, such as friends, locations and situations.[105] Association networks in the brain are greatly interlinked.[108]
Psychosis and antipsychotic drugs
Psychiatrists in the early 1950s discovered that a class of drugs known as typical antipsychotics (also known as major транквилизаторы ), were often effective at reducing the психотический symptoms of schizophrenia.[109] The introduction of the first widely used antipsychotic, хлорпромазин (Thorazine), in the 1950s, led to the release of many patients with schizophrenia from institutions in the years that followed.[109] By the 1970s researchers understood that these typical antipsychotics worked as антагонисты on the D2 receptors.[109][110] This realization led to the so-called dopamine hypothesis of schizophrenia, which postulates that schizophrenia is largely caused by hyperactivity of brain dopamine systems.[111] The dopamine hypothesis drew additional support from the observation that psychotic symptoms were often intensified by dopamine-enhancing stimulants such as methamphetamine, and that these drugs could also produce psychosis in healthy people if taken in large enough doses.[111] In the following decades other атипичные нейролептики that had fewer serious side effects were developed.[109] Many of these newer drugs do not act directly on dopamine receptors, but instead produce alterations in dopamine activity indirectly.[112] These drugs were also used to treat other psychoses.[109] Антипсихотические препараты have a broadly suppressive effect on most types of active behavior, and particularly reduce the delusional and agitated behavior characteristic of overt psychosis.[110]
Later observations, however, have caused the dopamine hypothesis to lose popularity, at least in its simple original form.[111] For one thing, patients with schizophrenia do not typically show measurably increased levels of brain dopamine activity.[111] Even so, many psychiatrists and neuroscientists continue to believe that schizophrenia involves some sort of dopamine system dysfunction.[109] As the "dopamine hypothesis" has evolved over time, however, the sorts of dysfunctions it postulates have tended to become increasingly subtle and complex.[109]
Психофармаколог Stephen M. Stahl suggested in a review of 2018 that in many cases of psychosis, including schizophrenia, three interconnected networks based on dopamine, serotonin, and glutamate - each on its own or in various combinations - contributed to an overexcitation of dopamine D2 receptors in the брюшное полосатое тело.[113]
Синдром дефицита внимания и гиперактивности
Altered dopamine neurotransmission is implicated in attention deficit hyperactivity disorder (ADHD), a condition associated with impaired когнитивный контроль, in turn leading to problems with regulating attention (attentional control ), inhibiting behaviors (тормозящий контроль ), and forgetting things or missing details (рабочая память ), among other problems.[114] There are genetic links between dopamine receptors, the dopamine transporter, and ADHD, in addition to links to other neurotransmitter receptors and transporters.[115] The most important relationship between dopamine and ADHD involves the drugs that are used to treat ADHD.[116] Some of the most effective therapeutic agents for ADHD are psychostimulants such as methylphenidate (Ritalin, Concerta) and амфетамин (Evekeo, Adderall, Dexedrine), drugs that increase both dopamine and norepinephrine levels in the brain.[116] The clinical effects of these psychostimulants in treating ADHD are mediated through the косвенная активация of dopamine and norepinephrine receptors, specifically дофаминовый рецептор D1 и adrenoceptor α2, in the prefrontal cortex.[114][117][118]
Боль
Dopamine plays a role in боль processing in multiple levels of the central nervous system including the spinal cord, periaqueductal gray, таламус, basal ganglia, and поясная извилина.[119] Decreased levels of dopamine have been associated with painful symptoms that frequently occur in Parkinson's disease.[119] Abnormalities in dopaminergic neurotransmission also occur in several painful clinical conditions, including синдром жжения во рту, фибромиалгия, and restless legs syndrome.[119]
Тошнота
Тошнота и рвота are largely determined by activity in the area postrema в мозговое вещество из мозговой ствол, в регионе, известном как chemoreceptor trigger zone.[120] This area contains a large population of type D2 dopamine receptors.[120] Consequently, drugs that activate D2 receptors have a high potential to cause nausea.[120] This group includes some medications that are administered for Parkinson's disease, as well as other агонисты дофамина Такие как апоморфин.[121] In some cases, D2-receptor antagonists such as метоклопрамид are useful as препараты против тошноты.[120]
Сравнительная биология и эволюция
Микроорганизмы
There are no reports of dopamine in археи, but it has been detected in some types of бактерии и в простейшие называется Тетрахимена.[122] Perhaps more importantly, there are types of bacteria that contain homologs of all the enzymes that animals use to synthesize dopamine.[123] It has been proposed that animals derived their dopamine-synthesizing machinery from bacteria, via горизонтальный перенос генов that may have occurred relatively late in evolutionary time, perhaps as a result of the симбиотический incorporation of bacteria into эукариотический cells that gave rise to митохондрии.[123]
Животные
Dopamine is used as a neurotransmitter in most multicellular animals.[124] В губки there is only a single report of the presence of dopamine, with no indication of its function;[125] however, dopamine has been reported in the nervous systems of many other радиально симметричный виды, в том числе cnidarian медуза, hydra и немного кораллы.[126] This dates the emergence of dopamine as a neurotransmitter back to the earliest appearance of the nervous system, over 500 million years ago in the Кембрийский Период. Dopamine functions as a neurotransmitter in позвоночные, иглокожие, членистоногие, моллюски, and several types of червь.[127][128]
In every type of animal that has been examined, dopamine has been seen to modify motor behavior.[124] в model organism, нематода Caenorhabditis elegans, это уменьшает движение and increases food-exploratory movements; в плоские черви it produces "screw-like" movements; в пиявки it inhibits swimming and promotes crawling. Across a wide range of vertebrates, dopamine has an "activating" effect on behavior-switching and response selection, comparable to its effect in mammals.[124][129]
Dopamine has also consistently been shown to play a role in reward learning, in all animal groups.[124] As in all vertebrates – беспозвоночные Такие как круглые черви, плоские черви, моллюски и common fruit flies can all be trained to repeat an action if it is consistently followed by an increase in dopamine levels.[124] В плодовые мошки, distinct elements for reward learning suggest a modular structure to the insect reward processing system that broadly parallels that the mammalian one.[130] For example, dopamine regulates short- and long-term learning in monkeys;[131] in fruit flies, different groups of dopamine neurons mediate reward signals for short- and long-term memories.[132]
It had long been believed that arthropods were an exception to this with dopamine being seen as having an adverse effect. Reward was seen to be mediated instead by octopamine, a neurotransmitter closely related to norepinephrine.[133] More recent studies, however, have shown that dopamine does play a part in reward learning in fruit flies. It has also been found that the rewarding effect of octopamine is due to its activating a set of dopaminergic neurons not previously accessed in the research.[133]
Растения
Many plants, including a variety of food plants, synthesize dopamine to varying degrees.[134] The highest concentrations have been observed in bananas—the fruit pulp of красный и yellow bananas contains dopamine at levels of 40 to 50 parts per million by weight.[134] Potatoes, avocados, broccoli, and Brussels sprouts may also contain dopamine at levels of 1 part per million or more; oranges, tomatoes, spinach, beans, and other plants contain measurable concentrations less than 1 part per million.[134] The dopamine in plants is synthesized from the amino acid tyrosine, by biochemical mechanisms similar to those that animals use.[134] It can be metabolized in a variety of ways, producing меланин и множество алкалоиды as byproducts.[134] The functions of plant catecholamines have not been clearly established, but there is evidence that they play a role in the response to stressors such as bacterial infection, act as growth-promoting factors in some situations, and modify the way that sugars are metabolized. The receptors that mediate these actions have not yet been identified, nor have the intracellular mechanisms that they activate.[134]
Dopamine consumed in food cannot act on the brain, because it cannot cross the blood–brain barrier.[21] However, there are also a variety of plants that contain L-DOPA, the metabolic precursor of dopamine.[135] The highest concentrations are found in the leaves and bean pods of plants of the genus Mucuna, особенно в Mucuna Pruriens (velvet beans), which have been used as a source for L-DOPA as a drug.[136] Another plant containing substantial amounts of L-DOPA is Vicia faba, the plant that produces fava beans (also known as "broad beans"). The level of L-DOPA in the beans, however, is much lower than in the pod shells and other parts of the plant.[137] Семена Кассия и Баухиния trees also contain substantial amounts of L-DOPA.[135]
In a species of морской зеленые водоросли Ulvaria obscura, a major component of some цветение водорослей, dopamine is present in very high concentrations, estimated at 4.4% of dry weight. There is evidence that this dopamine functions as an anti-травоядное животное defense, reducing consumption by snails and изоподы.[138]
As a precursor for melanin
Melanins are a family of dark-pigmented substances found in a wide range of organisms.[139] Chemically they are closely related to dopamine, and there is a type of melanin, known as dopamine-melanin, that can be synthesized by oxidation of dopamine via the enzyme тирозиназа.[139] The melanin that darkens human skin is not of this type: it is synthesized by a pathway that uses L-DOPA as a precursor but not dopamine.[139] However, there is substantial evidence that the neuromelanin that gives a dark color to the brain's substantia nigra is at least in part dopamine-melanin.[140]
Dopamine-derived melanin probably appears in at least some other biological systems as well. Some of the dopamine in plants is likely to be used as a precursor for dopamine-melanin.[141] The complex patterns that appear on butterfly wings, as well as black-and-white stripes on the bodies of insect larvae, are also thought to be caused by spatially structured accumulations of dopamine-melanin.[142]
История и развитие
Dopamine was first synthesized in 1910 by Джордж Баргер and James Ewens at Wellcome Laboratories in London, England[143] and first identified in the human brain by Kathleen Montagu in 1957. It was named dopamine because it is a моноамин whose precursor in the Barger-Ewens synthesis is 3,4-dihydrохупhenylаlanine (levodopa or L-DOPA). Dopamine's function as a neurotransmitter was first recognized in 1958 by Arvid Carlsson и Нильс-Оке Хилларп at the Laboratory for Chemical Pharmacology of the National Heart Institute of Швеция.[144] Carlsson was awarded the 2000 Нобелевская премия по физиологии и медицине for showing that dopamine is not only a precursor of norepinephrine (noradrenaline) and epinephrine (adrenaline), but is also itself a neurotransmitter.[145]
Polydopamine
Research motivated by клей polyphenolic proteins в моллюски led to the discovery in 2007 that a wide variety of materials, if placed in a solution of dopamine at slightly basic pH, will become coated with a layer of polymerized dopamine, often referred to as polydopamine.[146][147] This polymerized dopamine forms by a spontaneous oxidation reaction, and is formally a type of melanin.[148] Synthesis usually involves reaction of dopamine hydrochloride with Трис as a base in water. The structure of polydopamine is unknown.[147]
Polydopamine coatings can form on objects ranging in size from наночастицы to large surfaces.[148] Polydopamine layers have chemical properties that have the potential to be extremely useful, and numerous studies have examined their possible applications.[148] At the simplest level, they can be used for protection against damage by light, or to form capsules for drug delivery.[148] At a more sophisticated level, their adhesive properties may make them useful as substrates for биосенсоры or other biologically active macromolecules.[148]
Смотрите также
Рекомендации
- ^ а б c d "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. Международный союз фундаментальной и клинической фармакологии. Получено 29 января 2016.
- ^ Berridge, Kent C. (April 2007). "The debate over dopamine's role in reward: the case for incentive salience". Психофармакология. 191 (3): 391–431. Дои:10.1007/s00213-006-0578-x. ISSN 0033-3158. PMID 17072591. S2CID 468204.
- ^ а б c d е ж грамм час Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). Sydor A, Brown RY (eds.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. pp. 147–48, 366–67, 375–76. ISBN 978-0-07-148127-4.
- ^ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (October 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". Журнал неврологии. 33 (41): 16383–93. Дои:10.1523/JNEUROSCI.1731-13.2013. ЧВК 3792469. PMID 24107968.
- ^ а б Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (January 2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chemical Neuroscience. 6 (1): 16–26. Дои:10.1021/cn500255p. ЧВК 5820768. PMID 25491156.
Thus, fear-evoking stimuli are capable of differentially altering phasic dopamine transmission across NAcc subregions. The authors propose that the observed enhancement in NAcc shell dopamine likely reflects general motivational salience, perhaps due to relief from a CS-induced fear state when the US (foot shock) is not delivered. This reasoning is supported by a report from Budygin and colleagues112 showing that, in anesthetized rats, the termination of tail pinch results in augmented dopamine release in the shell.
- ^ Puglisi-Allegra S, Ventura R (June 2012). "Prefrontal/accumbal catecholamine system processes high motivational salience". Передний. Behav. Неврологи. 6: 31. Дои:10.3389/fnbeh.2012.00031. ЧВК 3384081. PMID 22754514.
- ^ Moncrieff J (2008). The myth of the chemical cure. A critique of psychiatric drug treatment. Basingstoke, UK: Palgrave MacMillan. ISBN 978-0-230-57432-8.
- ^ Volkow ND, Wang GJ, Kollins SH, Wigal TL, Newcorn JH, Telang F, Fowler JS, Zhu W, Logan J, Ma Y, Pradhan K, Wong C, Swanson JM (September 2009). "Evaluating dopamine reward pathway in ADHD: clinical implications". JAMA. 302 (10): 1084–91. Дои:10.1001/jama.2009.1308. ЧВК 2958516. PMID 19738093.
- ^ «Дофамин». PubChem. Получено 21 сентября 2015.
- ^ "Catecholamine". Британика. Получено 21 сентября 2015.
- ^ "Phenylethylamine". ChemicalLand21.com. Получено 21 сентября 2015.
- ^ а б c d е ж Carter JE, Johnson JH, Baaske DM (1982). "Dopamine Hydrochloride". Analytical Profiles of Drug Substances. 11: 257–72. Дои:10.1016/S0099-5428(08)60266-X. ISBN 9780122608117.
- ^ "Specification Sheet". www.sigmaaldrich.com. Получено 13 сентября 2019.
- ^ а б c Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ а б c Lindemann L, Hoener MC (май 2005 г.). "A renaissance in trace amines inspired by a novel GPCR family". Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ а б c d Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ а б c d е ж Seeman P (2009). "Chapter 1: Historical overview: Introduction to the dopamine receptors". In Neve K (ed.). The Dopamine Receptors. Springer. С. 1–22. ISBN 978-1-60327-333-6.
- ^ "EC 1.14.16.2 – Tyrosine 3-monooxygenase (Homo sapiens)". БРЕНДА. Technische Universität Braunschweig. Июль 2016. Получено 7 октября 2016.
Substrate: L-phenylalanine + tetrahydrobiopterin + O2
Product: L-tyrosine + 3-hydroxyphenylalanine [(aka m-tyrosine)] + dihydropteridine + H2O
Organism: Homo sapiens
Reaction diagram - ^ "EC 4.1.1.28 – Aromatic-L-amino-acid decarboxylase (Homo sapiens)". БРЕНДА. Technische Universität Braunschweig. Июль 2016. Получено 7 октября 2016.
Substrate: m-tyrosine
Product: m-tyramine + CO2
Organism: Homo sapiens
Reaction diagram - ^ а б c d е ж грамм час я j Musacchio JM (2013). "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines". In Iverson L (ed.). Biochemistry of Biogenic Amines. Springer. С. 1–35. ISBN 978-1-4684-3171-1.
- ^ а б c d е ж грамм час я j k The National Collaborating Centre for Chronic Conditions, ed. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Болезнь Паркинсона. Лондон: Королевский колледж врачей. pp. 59–100. ISBN 978-1-86016-283-1. Получено 24 сентября 2015.
- ^ а б c d е ж грамм час я j k Eisenhofer G, Kopin IJ, Goldstein DS (September 2004). "Catecholamine metabolism: a contemporary view with implications for physiology and medicine". Фармакологические обзоры. 56 (3): 331–49. Дои:10.1124/pr.56.3.1. PMID 15317907. S2CID 12825309.
- ^ Amin F, Davidson M, Davis KL (1992). "Homovanillic acid measurement in clinical research: a review of methodology". Бюллетень по шизофрении. 18 (1): 123–48. Дои:10.1093/schbul/18.1.123. PMID 1553492.
- ^ Amin F, Davidson M, Kahn RS, Schmeidler J, Stern R, Knott PJ, Apter S (1995). "Assessment of the central dopaminergic index of plasma HVA in schizophrenia". Бюллетень по шизофрении. 21 (1): 53–66. Дои:10.1093/schbul/21.1.53. PMID 7770741.
- ^ Зульцер Д., Зекка Л. (февраль 2000 г.). «Интранейрональный синтез дофамин-хинона: обзор». Исследования нейротоксичности. 1 (3): 181–95. Дои:10.1007 / BF03033289. PMID 12835101. S2CID 21892355.
- ^ Миядзаки I, Асанума М (июнь 2008 г.). «Дофаминергический нейрон-специфический окислительный стресс, вызванный самим дофамином» (PDF). Acta Medica Okayama. 62 (3): 141–50. Дои:10.18926 / AMO / 30942. PMID 18596830.
- ^ а б c d е Гранди Д. К., Миллер Г. М., Ли Дж. Х. (февраль 2016 г.). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Наркотическая и алкогольная зависимость. 159: 9–16. Дои:10.1016 / j.drugalcdep.2015.11.014. ЧВК 4724540. PMID 26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ а б c d Romanelli RJ, Williams JT, Neve KA (2009). "Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior". In Neve KA (ed.). The Dopamine Receptors. Springer. pp. 137–74. ISBN 978-1-60327-333-6.
- ^ а б Eiden LE, Schäfer MK, Weihe E, Schütz B (February 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv. 447 (5): 636–40. Дои:10.1007/s00424-003-1100-5. PMID 12827358. S2CID 20764857.
- ^ а б Miller GM (January 2011). «Возникающая роль следового аминосвязанного рецептора 1 в функциональной регуляции переносчиков моноаминов и дофаминергической активности». Журнал нейрохимии. 116 (2): 164–76. Дои:10.1111 / j.1471-4159.2010.07109.x. ЧВК 3005101. PMID 21073468.
- ^ а б Болье Дж. М., Гайнетдинов Р. Р. (март 2011 г.). «Физиология, сигнализация и фармакология дофаминовых рецепторов». Фармакологические обзоры. 63 (1): 182–217. Дои:10.1124 / пр.110.002642. PMID 21303898. S2CID 2545878.
- ^ Torres GE, Gainetdinov RR, Caron MG (January 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Обзоры природы. Неврология. 4 (1): 13–25. Дои:10.1038 / nrn1008. PMID 12511858. S2CID 21545649.
- ^ а б c d Rice ME, Patel JC, Cragg SJ (December 2011). "Dopamine release in the basal ganglia". Неврология. 198: 112–37. Дои:10.1016/j.neuroscience.2011.08.066. ЧВК 3357127. PMID 21939738.
- ^ Schultz W (2007). "Multiple dopamine functions at different time courses". Ежегодный обзор нейробиологии. 30: 259–88. Дои:10.1146/annurev.neuro.28.061604.135722. PMID 17600522. S2CID 13503219.
- ^ а б c d е ж грамм час я Björklund A, Dunnett SB (May 2007). "Dopamine neuron systems in the brain: an update". Тенденции в неврологии. 30 (5): 194–202. Дои:10.1016/j.tins.2007.03.006. PMID 17408759. S2CID 14239716.
- ^ а б Dahlstroem A, Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica. Дополнение. 232: SUPPL 232:1–55. PMID 14229500.
- ^ а б c d Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. pp. 147–48, 154–57. ISBN 978-0-07-148127-4.
- ^ Christine CW, Aminoff MJ (September 2004). "Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance". Американский журнал медицины. 117 (6): 412–19. Дои:10.1016/j.amjmed.2004.03.032. PMID 15380498.
- ^ Fadok JP, Dickerson TM, Palmiter RD (September 2009). "Dopamine is necessary for cue-dependent fear conditioning". Журнал неврологии. 29 (36): 11089–97. Дои:10.1523/JNEUROSCI.1616-09.2009. ЧВК 2759996. PMID 19741115.
- ^ Tang W, Kochubey O, Kintscher M, Schneggenburger R (April 2020). "A VTA to basal amygdala dopamine projection contributes to signal salient somatosensory events during fear learning". Журнал неврологии. 40 (20): JN–RM–1796-19. Дои:10.1523/JNEUROSCI.1796-19.2020. ЧВК 7219297. PMID 32277045.
- ^ Jo YS, Heymann G, Zweifel LS (November 2018). "Dopamine Neurons Reflect the Uncertainty in Fear Generalization". Нейрон. 100 (4): 916–925.e3. Дои:10.1016/j.neuron.2018.09.028. ЧВК 6226002. PMID 30318411.
- ^ а б Paulus W, Schomburg ED (June 2006). "Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?". Отзывы о медицине сна. 10 (3): 185–96. Дои:10.1016/j.smrv.2006.01.004. PMID 16762808.
- ^ а б c d е ж Ben-Jonathan N, Hnasko R (December 2001). "Dopamine as a prolactin (PRL) inhibitor". Эндокринные обзоры. 22 (6): 724–63. Дои:10.1210/er.22.6.724. PMID 11739329.
- ^ а б c d Witkovsky P (January 2004). "Dopamine and retinal function". Documenta Ophthalmologica. Достижения в офтальмологии. 108 (1): 17–40. Дои:10.1023/B:DOOP.0000019487.88486.0a. PMID 15104164. S2CID 10354133.
- ^ а б Fix JD (2008). "Basal Ganglia and the Striatal Motor System". Neuroanatomy (Board Review Series) (4-е изд.). Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins. pp. 274–81. ISBN 978-0-7817-7245-7.
- ^ а б c d е ж Chakravarthy VS, Joseph D, Bapi RS (September 2010). "What do the basal ganglia do? A modeling perspective". Биологическая кибернетика. 103 (3): 237–53. Дои:10.1007/s00422-010-0401-y. PMID 20644953. S2CID 853119.
- ^ а б c d Floresco SB (January 2015). "The nucleus accumbens: an interface between cognition, emotion, and action". Ежегодный обзор психологии. 66: 25–52. Дои:10.1146/annurev-psych-010213-115159. PMID 25251489.
- ^ а б Balleine BW, Dezfouli A, Ito M, Doya K (2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Текущее мнение в области поведенческих наук. 5: 1–7. Дои:10.1016/j.cobeha.2015.06.001. S2CID 53148662.
- ^ а б c Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Журнал неврологии, нейрохирургии и психиатрии. 79 (4): 368–76. Дои:10.1136/jnnp.2007.131045. PMID 18344392.
- ^ Pattij T, Vanderschuren LJ (April 2008). "The neuropharmacology of impulsive behaviour". Тенденции в фармакологических науках. 29 (4): 192–99. Дои:10.1016/j.tips.2008.01.002. PMID 18304658.
- ^ а б c d е ж грамм час я j k л м Schultz W (July 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Физиологические обзоры. 95 (3): 853–951. Дои:10.1152/physrev.00023.2014. ЧВК 4491543. PMID 26109341.
- ^ а б c Robinson TE, Berridge KC (1993). "The neural basis of drug craving: an incentive-sensitization theory of addiction". Исследование мозга. Обзоры исследований мозга. 18 (3): 247–91. Дои:10.1016/0165-0173(93)90013-p. HDL:2027.42/30601. PMID 8401595. S2CID 13471436.
- ^ Wright JS, Panksepp J (2012). "An evolutionary framework to understand foraging, wanting, and desire: the neuropsychology of the SEEKING system". Neuropsychoanalysis. 14 (1): 5–39. Дои:10.1080/15294145.2012.10773683. S2CID 145747459. Получено 24 сентября 2015.
- ^ а б c d е Berridge KC, Robinson TE, Aldridge JW (February 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Текущее мнение в фармакологии. 9 (1): 65–73. Дои:10.1016/j.coph.2008.12.014. ЧВК 2756052. PMID 19162544.
- ^ Bromberg-Martin ES, Matsumoto M, Hikosaka O (December 2010). "Dopamine in motivational control: rewarding, aversive, and alerting". Нейрон. 68 (5): 815–34. Дои:10.1016/j.neuron.2010.11.022. ЧВК 3032992. PMID 21144997.
- ^ Ягер Л.М., Гарсия А.Ф., Вунш А.М., Фергюсон С.М. (август 2015 г.). «Все аспекты полосатого тела: роль в наркомании». Неврология. 301: 529–41. Дои:10.1016 / j.neuroscience.2015.06.033. ЧВК 4523218. PMID 26116518.
- ^ а б Saddoris MP, Cacciapaglia F, Wightman RM, Carelli RM (August 2015). "Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation". Журнал неврологии. 35 (33): 11572–82. Дои:10.1523/JNEUROSCI.2344-15.2015. ЧВК 4540796. PMID 26290234.
- ^ Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Нейрон. 86 (3): 646–64. Дои:10.1016/j.neuron.2015.02.018. ЧВК 4425246. PMID 25950633.
- ^ а б c Wise RA (1996). "Addictive drugs and brain stimulation reward". Ежегодный обзор нейробиологии. 19: 319–40. Дои:10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ Wise RA (October 2008). "Dopamine and reward: the anhedonia hypothesis 30 years on". Исследования нейротоксичности. 14 (2–3): 169–83. Дои:10.1007/BF03033808. ЧВК 3155128. PMID 19073424.
- ^ Arias-Carrión O, Pöppel E (2007). "Dopamine, learning and reward-seeking behavior". Acta Neurobiol Exp. 67 (4): 481–88.
- ^ Ikemoto, Satoshi (November 2007). «Схема вознаграждения дофамина: две проекционные системы от брюшной части среднего мозга до комплекса прилежащего ядра и обонятельного бугорка». Обзоры исследований мозга. 56 (1): 27–78. Дои:10.1016 / j.brainresrev.2007.05.004. ISSN 0165-0173. ЧВК 2134972. PMID 17574681.
- ^ а б Ferreri L, Mas-Herrero E, Zatorre RJ, Ripollés P, Gomez-Andres A, Alicart H, Olivé G, Marco-Pallarés J, Antonijoan RM, Valle M, Riba J, Rodriguez-Fornells A (январь 2019 г.). «Дофамин модулирует восприятие удовольствия от музыки». Труды Национальной академии наук Соединенных Штатов Америки. 116 (9): 3793–3798. Дои:10.1073 / pnas.1811878116. ЧВК 6397525. PMID 30670642. Сложить резюме – Новости нейробиологии (24 января 2019 г.).
Прослушивание приятной музыки часто сопровождается измеримыми телесными реакциями, такими как мурашки по коже или дрожь по позвоночнику, обычно называемые «ознобом» или «дрожью». ... В целом, наши результаты однозначно показали, что фармакологические вмешательства двунаправленно модулируют ответную реакцию на вознаграждение, вызываемую музыкой. В частности, мы обнаружили, что рисперидон ухудшает способность участников испытывать музыкальное удовольствие, тогда как леводопа усиливает его. ... Здесь, напротив, изучая реакцию людей на абстрактные награды, мы показываем, что манипуляции с дофаминергической передачей влияют как на удовольствие (т. Е. Количество времени, в течение которого сообщается об ознобе и эмоциональном возбуждении, измеряемое с помощью EDA), так и на мотивационные компоненты музыкального вознаграждения. (деньги готовы потратить). Эти данные предполагают, что дофаминергическая передача сигналов является непременным условием не только для мотивационных реакций, как было показано с первичным и вторичным вознаграждением, но и для гедонистических реакций на музыку. Этот результат подтверждает недавние открытия, показывающие, что дофамин также опосредует воспринимаемое удовольствие, достигаемое другими типами абстрактных вознаграждений (37), и ставит под сомнение предыдущие результаты исследований на животных моделях по первичным вознаграждениям, таким как еда (42, 43).
- ^ а б Goupil L, Aucouturier JJ (февраль 2019 г.). «Музыкальное удовольствие и музыкальные эмоции». Труды Национальной академии наук Соединенных Штатов Америки. 116 (9): 3364–3366. Дои:10.1073 / pnas.1900369116. ЧВК 6397567. PMID 30770455.
В фармакологическом исследовании, опубликованном в PNAS, Ferreri et al. (1) представляют доказательства того, что усиление или ингибирование передачи сигналов дофамина с помощью леводопы или рисперидона модулирует удовольствие, испытываемое при прослушивании музыки. ... В завершение, чтобы установить не только корреляционную, но и причинную роль дофамина в музыкальном удовольствии, авторы обратились к непосредственному манипулированию дофаминергическими сигналами в полосатом теле, сначала применяя возбуждающую и тормозящую транскраниальную магнитную стимуляцию над участниками ''. левая дорсолатеральная префронтальная кора, область, которая, как известно, модулирует стриарную функцию (5), и, наконец, в текущем исследовании, путем введения фармацевтических агентов, способных изменить синаптическую доступность дофамина (1), оба из которых влияют на воспринимаемое удовольствие, физиологические показатели возбуждения, и денежное выражение, присвоенное музыке в предсказанном направлении. ... Хотя вопрос о музыкальном выражении эмоций имеет долгую историю исследований, в том числе в PNAS (6), а психофизиологические исследования 1990-х годов уже установили, что музыкальное удовольствие может активировать вегетативную нервную систему (7), Демонстрация авторами влияния системы вознаграждения на музыкальные эмоции была воспринята как первое доказательство того, что это были достоверные эмоции, исследование которых имеет полное право информировать нейробиологию о наших повседневных когнитивных, социальных и аффективных функциях (8). Между прочим, это направление работы, кульминацией которого стала статья Феррери и др. (1), вероятно, сделал больше для привлечения финансирования исследований в области музыкальных наук, чем кто-либо другой в этом сообществе.
Свидетельства Ferreri et al. (1) обеспечивает последнюю поддержку убедительной нейробиологической модели, в которой музыкальное удовольствие возникает в результате взаимодействия древних систем вознаграждения / оценки (полосатая – лимбическая – паралимбическая) с более филогенетически развитыми системами восприятия / прогнозирования (темпорофронтальная). - ^ а б Missale C, Nash SR, Robinson SW, Jaber M, Caron MG (январь 1998 г.). «Дофаминовые рецепторы: от структуры к функции» (PDF). Физиологические обзоры. 78 (1): 189–225. Дои:10.1152 / Physrev.1998.78.1.189. PMID 9457173. S2CID 223462.
- ^ а б Буттарелли FR, Fanciulli A, Pellicano C, Pontieri FE (июнь 2011 г.). «Дофаминергическая система в лимфоцитах периферической крови: от физиологии до фармакологии и потенциальные применения в нейропсихиатрических расстройствах». Современная нейрофармакология. 9 (2): 278–88. Дои:10.2174/157015911795596612. ЧВК 3131719. PMID 22131937.
- ^ а б Саркар С., Басу Б., Чакроборти Д., Дасгупта П.С., Басу С. (май 2010 г.). «Иммунорегуляторная роль дофамина: новая информация». Мозг, поведение и иммунитет. 24 (4): 525–28. Дои:10.1016 / j.bbi.2009.10.015. ЧВК 2856781. PMID 19896530.
- ^ Хуссейн Т., Локхандвала М.Ф. (февраль 2003 г.). «Почечные дофаминовые рецепторы и гипертония». Экспериментальная биология и медицина. 228 (2): 134–42. Дои:10.1177/153537020322800202. PMID 12563019. S2CID 10896819.
- ^ Choi MR, Kouyoumdzian NM, Rukavina Mikusic NL, Kravetz MC, Rosón MI, Rodríguez Fermepin M, Fernández BE (май 2015 г.). «Почечная дофаминергическая система: патофизиологические последствия и клинические перспективы». Всемирный журнал нефрологии. 4 (2): 196–212. Дои:10.5527 / wjn.v4.i2.196. ЧВК 4419129. PMID 25949933.
- ^ Кэри Р.М. (сентябрь 2001 г.). «Лекция Теодора Купера: Почечная дофаминовая система: паракринный регулятор гомеостаза натрия и артериального давления». Гипертония. 38 (3): 297–302. Дои:10.1161 / hy0901.096422. PMID 11566894.
- ^ а б c d е Руби Б., Махлер П. (декабрь 2010 г.). «Мини-обзор: новые роли периферического дофамина в контроле метаболизма и росте опухоли: давайте искать баланс». Эндокринология. 151 (12): 5570–81. Дои:10.1210 / en.2010-0745. PMID 21047943.
- ^ «Примерный перечень основных лекарственных средств ВОЗ» (PDF). Всемирная организация здоровья. Октябрь 2013. Получено 24 сентября 2015.
- ^ Нури С., Фридлих П., Серия I (2003). «Обзор фармакологии, регулируемые развитием сердечно-сосудистых, почечных и нейроэндокринных эффектов дофамина». NeoReviews. 4 (10): e283 – e288. Дои:10.1542 / neo.4-10-e283. Получено 24 сентября 2015.
- ^ а б Bhatt-Mehta V, Nahata MC (1989). «Дофамин и добутамин в педиатрической терапии». Фармакотерапия. 9 (5): 303–14. Дои:10.1002 / j.1875-9114.1989.tb04142.x. PMID 2682552. S2CID 25614283.
- ^ а б c Бронвен Дж. Б., Рыцари К. М. (2009). Фармакология для медицинских работников (2-е изд.). Эльзевир Австралия. п. 192. ISBN 978-0-7295-3929-6.
- ^ Де Бакер Д., Бистон П., Девриендт Дж., Мадл С., Чохрад Д., Альдекоа С., Брассер А., Дефранс П., Готтиньи П., Винсент Дж. Л. (март 2010 г.). «Сравнение дофамина и норэпинефрина при лечении шока» (PDF). Медицинский журнал Новой Англии. 362 (9): 779–89. Дои:10.1056 / NEJMoa0907118. PMID 20200382. S2CID 2208904.
- ^ Картик С., Лиссабон А (2006). «Низкие дозы дофамина в реанимации». Семинары по диализу. 19 (6): 465–71. Дои:10.1111 / j.1525-139X.2006.00208.x. PMID 17150046. S2CID 22538344.
- ^ Моисей, Скотт. «Дофамин». Записная книжка по семейной практике. Получено 1 февраля 2016.
- ^ Катритсис Д.Г., Герш Б.Дж., Камм А.Дж. (19 сентября 2013 г.). Клиническая кардиология: текущие практические рекомендации. ОУП Оксфорд. ISBN 978-0-19-150851-6.
Дофамин связывается с бета-1, бета-2, альфа-1 и дофаминергическими рецепторами
- ^ Льюис Р.Дж. (2004). Опасные свойства промышленных материалов Sax (11-е изд.). Хобокен, Нью-Джерси: Wiley & Sons. п. 1552. ISBN 978-0-471-47662-7.
- ^ Дэн В.П., Вонг К.А., Кирк К.Л. (2002). «Удобные синтезы 2-, 5- и 6-фтор- и 2,6-дифтор-L-ДОФА». Тетраэдр: асимметрия. 13 (11): 1135–40. Дои:10.1016 / S0957-4166 (02) 00321-X.
- ^ Штандерт Д.Г., Уолш Р.Р. (2011). «Фармакология дофаминергической нейротрансмиссии». В Tashjian AH, Armstrong EJ, Golan DE (ред.). Принципы фармакологии: патофизиологические основы лекарственной терапии. Липпинкотт Уильямс и Уилкинс. С. 186–206. ISBN 978-1-4511-1805-6.
- ^ Mobbs CV, Hof PR (2009). Справочник по нейробиологии старения. Амстердам: Elsevier / Academic Press. ISBN 978-0-12-374898-0. OCLC 299710911.
- ^ Ота М., Ясуно Ф, Ито Х, Секи С., Нодзаки С., Асада Т., Сухара Т. (июль 2006 г.). «Возрастное снижение синтеза дофамина в живом мозге человека, измеренное с помощью позитронно-эмиссионной томографии с L- [бета-11C] ДОФА». Науки о жизни. 79 (8): 730–36. Дои:10.1016 / j.lfs.2006.02.017. PMID 16580023.
- ^ Каасинен В., Вилкман Х., Хиетала Дж., Ногрен К., Хелениус Х., Олссон Х., Фарде Л., Ринне Дж. (2000). «Возрастная потеря рецепторов допамина D2 / D3 в экстрастриатальных областях человеческого мозга». Нейробиология старения. 21 (5): 683–68. Дои:10.1016 / S0197-4580 (00) 00149-4. PMID 11016537. S2CID 40871554.
- ^ Ван И, Чан Г.Л., Холден Дж. Э., Добко Т., Мак Э., Шульцер М., Хузер Дж. М., Сноу Б. Дж., Рут Т. Дж., Калне Д. Б., Штёссл А. Дж. (Сентябрь 1998 г.). «Возрастное снижение дофаминовых рецепторов D1 в мозге человека: исследование ПЭТ». Синапс. 30 (1): 56–61. Дои:10.1002 / (SICI) 1098-2396 (199809) 30: 1 <56 :: AID-SYN7> 3.0.CO; 2-J. PMID 9704881.
- ^ а б Вонг Д.Ф., Вагнер Х.Н., Данналс Р.Ф., Линкс Дж. М., Фрост Дж. Дж., Раверт Х. Т., Уилсон А. А., Розенбаум А. Э., Джедде А., Дуглас К. Х. (декабрь 1984 г.). «Влияние возраста на рецепторы дофамина и серотонина, измеренные с помощью позитронной томографии в живом мозге человека». Наука. 226 (4681): 1393–96. Bibcode:1984Научный ... 226,1393W. Дои:10.1126 / science.6334363. PMID 6334363. S2CID 24278577.
- ^ а б Ван Э., Снайдер С (1998). Справочник стареющего мозга. Сан-Диего, Калифорния: Academic Press. ISBN 978-0-12-734610-6. OCLC 636693117.
- ^ Чанг Л., Цзян К.С., Эрнст Т. (январь 2009 г.). «Влияние возраста и пола на глутамат мозга и другие метаболиты». Магнитно-резонансная томография. 27 (1): 142–45. Дои:10.1016 / j.mri.2008.06.002. ЧВК 3164853. PMID 18687554.
- ^ Добрякова Е., Генова Х.М., ДеЛука Дж., Уайли Г.Р. (12 марта 2015 г.). «Гипотеза дисбаланса дофамина, приводящая к усталости при рассеянном склерозе и других неврологических расстройствах». Границы неврологии. 6: 52. Дои:10.3389 / fneur.2015.00052. ЧВК 4357260. PMID 25814977.
- ^ Марино Ф, Косентино М (апрель 2016 г.). «Рассеянный склероз: перепрофилирование дофаминергических препаратов для лечения рассеянного склероза - доказательства накапливаются». Обзоры природы. Неврология. 12 (4): 191–2. Дои:10.1038 / nrneurol.2016.33. PMID 27020558. S2CID 26319461.
- ^ Диксон Д.В. (2007). «Невропатология двигательных расстройств». In Tolosa E, Jankovic JJ (ред.). Болезнь Паркинсона и двигательные расстройства. Хагерстаун, Мэриленд: Липпинкотт Уильямс и Уилкинс. С. 271–83. ISBN 978-0-7817-7881-7.
- ^ а б Tuite PJ, Krawczewski K (апрель 2007 г.). «Паркинсонизм: обзор системного подхода к диагностике». Семинары по неврологии. 27 (2): 113–22. Дои:10.1055 / с-2007-971174. PMID 17390256.
- ^ а б Олсен CM (декабрь 2011 г.). «Естественные награды, нейропластичность и немедикаментозные зависимости». Нейрофармакология. 61 (7): 1109–22. Дои:10.1016 / j.neuropharm.2011.03.010. ЧВК 3139704. PMID 21459101.
- ^ Чераволо Р., Фрозини Д., Росси К., Бонучелли Ю. (ноябрь 2010 г.). «Спектр зависимостей при болезни Паркинсона: от синдрома дисрегуляции дофамина до нарушений импульсного контроля». Журнал неврологии. 257 (Дополнение 2): S276–83. Дои:10.1007 / s00415-010-5715-0. PMID 21080189. S2CID 19277026.
- ^ а б c d е ж грамм Ghodse H (2010). Наркотики и привыкание Годсе: Руководство по лечению (4-е изд.). Издательство Кембриджского университета. С. 87–92. ISBN 978-1-139-48567-8.
- ^ Heal DJ, Пирс DM (2006). «Метилфенидат и его изомеры: их роль в лечении синдрома дефицита внимания с гиперактивностью с использованием трансдермальной системы доставки». Препараты ЦНС. 20 (9): 713–38. Дои:10.2165/00023210-200620090-00002. PMID 16953648. S2CID 39535277.
- ^ а б Фрей Э (2009). Фармакология и злоупотребление кокаином, амфетаминами, экстази и родственными дизайнерскими наркотиками всесторонний обзор их механизма действия, лечения злоупотребления и интоксикации. Дордрехт: Спрингер. ISBN 978-90-481-2448-0.
- ^ а б Кимко ХК, Кросс JT, Абернети Д.Р. (декабрь 1999 г.). «Фармакокинетика и клиническая эффективность метилфенидата». Клиническая фармакокинетика. 37 (6): 457–70. Дои:10.2165/00003088-199937060-00002. PMID 10628897. S2CID 397390.
- ^ Mignot EJ (октябрь 2012 г.). «Практическое руководство по терапии синдромов нарколепсии и гиперсомнии». Нейротерапия. 9 (4): 739–52. Дои:10.1007 / s13311-012-0150-9. ЧВК 3480574. PMID 23065655.
- ^ Циммерман Дж. Л. (октябрь 2012 г.). «Кокаиновая интоксикация». Клиники интенсивной терапии. 28 (4): 517–26. Дои:10.1016 / j.ccc.2012.07.003. PMID 22998988.
- ^ «DailyMed - КВИЛЛИВАНТ XR-суспензия гидрохлорида метилфенидата пролонгированного действия». dailymed.nlm.nih.gov. Получено 11 июля 2020.
- ^ Лопес, Франк А .; Леру, Жак Р. (2013). «Стимуляторы длительного действия для лечения синдрома дефицита внимания / гиперактивности: основное внимание уделяется составам с пролонгированным высвобождением и пролекарству лиздексамфетамина димезилат для решения сохраняющихся клинических проблем». Синдром дефицита внимания и гиперактивности. 5 (3): 249–265. Дои:10.1007 / с12402-013-0106-х. ISSN 1866-6116. ЧВК 3751218. PMID 23564273.
- ^ Nutt DJ, Lingford-Hughes A, Erritzoe D, Stokes PR (май 2015 г.). «Дофаминовая теория зависимости: 40 лет взлетов и падений» (PDF). Обзоры природы. Неврология. 16 (5): 305–12. Дои:10.1038 / номер 3939. PMID 25873042. S2CID 205511111.
- ^ а б c Синха Р. (август 2013 г.). «Клиническая нейробиология тяги к наркотикам». Текущее мнение в нейробиологии. 23 (4): 649–54. Дои:10.1016 / j.conb.2013.05.001. ЧВК 3735834. PMID 23764204.
- ^ Волков Н.Д., Балер Р.Д. (январь 2014 г.). «Наука о наркозависимости: раскрытие нейробиологической сложности». Нейрофармакология. 76 Pt B: 235–49. Дои:10.1016 / j.neuropharm.2013.05.007. ЧВК 3818510. PMID 23688927.
- ^ Нестлер EJ (декабрь 2012 г.). «Транскрипционные механизмы наркозависимости». Клиническая психофармакология и неврология. 10 (3): 136–43. Дои:10.9758 / cpn.2012.10.3.136. ЧВК 3569166. PMID 23430970.
- ^ Йео Б.Т., Криенен Ф.М., Сепулькр Дж., Сабунку М.Р., Лашкари Д., Холлинсхед М., Роффман Дж. Л., Смоллер Дж. В., Цёллей Л., Полимени Дж. Р., Фишл Б., Лю Х., Бакнер Р. Л. (сентябрь 2011 г.). «Организация коры головного мозга человека оценивается по внутренним функциональным связям». Журнал нейрофизиологии. 106 (3): 1125–65. Дои:10.1152 / ян.00338.2011. ЧВК 3174820. PMID 21653723.
- ^ а б c d е ж грамм Хили Д. (2004). Создание психофармакологии. Издательство Гарвардского университета. С. 37–73. ISBN 978-0-674-01599-9.
- ^ а б Брантон Л. Гудман и Гилман "Фармакологические основы терапии" (12-е изд.). Макгроу Хилл. С. 417–55.
- ^ а б c d Хоус О.Д., Капур С. (май 2009 г.). «Дофаминовая гипотеза шизофрении: версия III - последний общий путь». Бюллетень по шизофрении. 35 (3): 549–62. Дои:10.1093 / schbul / sbp006. ЧВК 2669582. PMID 19325164.
- ^ Horacek J, Bubenikova-Valesova V, Kopecek M, Palenicek T., Dockery C, Mohr P, Höschl C (2006). «Механизм действия атипичных антипсихотических препаратов и нейробиология шизофрении». Препараты ЦНС. 20 (5): 389–409. Дои:10.2165/00023210-200620050-00004. PMID 16696579. S2CID 18226404.
- ^ Шталь С.М. (2018). «За пределами допаминовой гипотезы шизофрении к трем нейронным сетям психоза: дофамин, серотонин и глутамат» (PDF). ЦНС Спектр. 23 (3): 187–191. Дои:10.1017 / S1092852918001013. PMID 29954475.
- ^ а б Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Главы 10 и 13». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. С. 266, 318–23. ISBN 978-0-07-148127-4.
- ^ Ву Дж, Сяо Х, Сунь Х, Цзоу Л., Чжу LQ (июнь 2012 г.). «Роль дофаминовых рецепторов при СДВГ: систематический метаанализ». Молекулярная нейробиология. 45 (3): 605–20. Дои:10.1007 / s12035-012-8278-5. PMID 22610946. S2CID 895006.
- ^ а б Берридж CW, Devilbiss DM (июнь 2011 г.). «Психостимуляторы как усилители когнитивных функций: префронтальная кора, катехоламины и синдром дефицита внимания / гиперактивности». Биологическая психиатрия. 69 (12): e101–11. Дои:10.1016 / j.biopsych.2010.06.023. ЧВК 3012746. PMID 20875636.
- ^ Спенсер Р.К., Девилбисс Д.М., Берридж CW (июнь 2015 г.). «Эффекты психостимуляторов, улучшающие когнитивные способности, включают прямое действие в префронтальной коре головного мозга». Биологическая психиатрия. 77 (11): 940–50. Дои:10.1016 / j.biopsych.2014.09.013. ЧВК 4377121. PMID 25499957.
- ^ Илиева И.П., Хук CJ, Фарах MJ (июнь 2015). «Влияние рецептурных стимуляторов на здоровый ингибиторный контроль, рабочую память и эпизодическую память: метаанализ». Журнал когнитивной неврологии. 27 (6): 1069–89. Дои:10.1162 / jocn_a_00776. PMID 25591060. S2CID 15788121.
- ^ а б c Wood PB (май 2008 г.). «Роль центрального дофамина в боли и обезболивании». Экспертный обзор нейротерапии. 8 (5): 781–97. Дои:10.1586/14737175.8.5.781. PMID 18457535. S2CID 24325199.
- ^ а б c d Flake ZA, Scalley RD, Bailey AG (март 2004 г.). «Практический подбор противорвотных средств». Американский семейный врач. 69 (5): 1169–74. PMID 15023018.
- ^ Коннолли Б.С., Ланг А.Е. (2014). «Фармакологическое лечение болезни Паркинсона: обзор». JAMA. 311 (16): 1670–83. Дои:10.1001 / jama.2014.3654. PMID 24756517.
- ^ Рощина В.В. (2010). «Эволюционные соображения нейромедиаторов в микробных, растительных и животных клетках». В Lyte M, Primrose PE (ред.). Микробная эндокринология. Нью-Йорк: Спрингер. С. 17–52. ISBN 978-1-4419-5576-0.
- ^ а б Айер Л.М., Аравинд Л., Кун С.Л., Кляйн Д.К., Кунин Е.В. (июль 2004 г.). «Эволюция межклеточной передачи сигналов у животных: играет ли роль поздний горизонтальный перенос генов от бактерий?». Тенденции в генетике. 20 (7): 292–99. Дои:10.1016 / j.tig.2004.05.007. PMID 15219393.
- ^ а б c d е Баррон А.Б., Сёвик Э., Корниш Дж. Л. (2010). «Роль дофамина и родственных соединений в поведении, связанном с поиском награды, у животных разных типов». Границы поведенческой нейробиологии. 4: 163. Дои:10.3389 / fnbeh.2010.00163. ЧВК 2967375. PMID 21048897.
- ^ Лю Х., Мисима Й., Фудзивара Т., Нагаи Х., Китадзава А., Майн И и др. (2004). "Выделение арагуспонгина M, нового стереоизомера алкалоида арагуспонгина / ксестоспонгина, и дофамина из морской губки. Неопетрозия эксигуа собраны в Палау ». Морские препараты. 2 (4): 154–63. Дои:10.3390 / md204154. ЧВК 3783253.
- ^ Касс-Саймон Дж., Пьеробон П. (январь 2007 г.). «Книдарианская химическая нейротрансмиссия, обновленный обзор». Сравнительная биохимия и физиология. Часть A, Молекулярная и интегративная физиология. 146 (1): 9–25. Дои:10.1016 / j.cbpa.2006.09.008. PMID 17101286.
- ^ Коттрелл Г.А. (январь 1967 г.). «Появление дофамина и норадреналина в нервной ткани некоторых видов беспозвоночных». Британский журнал фармакологии и химиотерапии. 29 (1): 63–69. Дои:10.1111 / j.1476-5381.1967.tb01939.x. ЧВК 1557178. PMID 19108240.
- ^ Киндт К.С., Кваст К.Б., Джайлс А.С., Де С., Хендри Д., Никастро И., Ранкин С.Х., Шафер В.Р. (август 2007 г.). «Дофамин опосредует контекстно-зависимую модуляцию сенсорной пластичности у C. elegans». Нейрон. 55 (4): 662–76. Дои:10.1016 / j.neuron.2007.07.023. PMID 17698017. S2CID 2092645.
- ^ Каливас П. У., Стюарт Дж. (1 сентября 1991 г.). «Передача допамина в инициировании и выражении лекарственной сенсибилизации и стресс-индуцированной сенсибилизации двигательной активности». Исследование мозга. Обзоры исследований мозга. 16 (3): 223–44. Дои:10.1016 / 0165-0173 (91) 90007-У. PMID 1665095. S2CID 10775295.
- ^ Перри CJ, Баррон AB (2013). «Нейронные механизмы вознаграждения у насекомых» (PDF). Ежегодный обзор энтомологии. 58 (1): 543–62. Дои:10.1146 / annurev-ento-120811-153631. PMID 23020615. S2CID 19678766.
- ^ Такикава Ю., Кавагое Р., Хикосака О. (октябрь 2004 г.). «Возможная роль дофаминовых нейронов среднего мозга в краткосрочной и долгосрочной адаптации саккад к отображению положения и вознаграждения» (PDF). Журнал нейрофизиологии. 92 (4): 2520–9. Дои:10.1152 / ян.00238.2004. PMID 15163669. S2CID 12534057.
- ^ Yamagata N, Ichinose T, Aso Y, Plaçais PY, Friedrich AB, Sima RJ и др. (Январь 2015 г.). «Отчетливые дофаминовые нейроны опосредуют сигналы вознаграждения за краткосрочные и долгосрочные воспоминания». Труды Национальной академии наук Соединенных Штатов Америки. 112 (2): 578–83. Bibcode:2015ПНАС..112..578Л. Дои:10.1073 / pnas.1421930112. ЧВК 4299218. PMID 25548178.
- ^ а б Waddell S (июнь 2013 г.). «Передача сигналов подкрепления у дрозофилы; все же дофамин делает все». Текущее мнение в нейробиологии. 23 (3): 324–29. Дои:10.1016 / j.conb.2013.01.005. ЧВК 3887340. PMID 23391527.
- ^ а б c d е ж Кульма А., Сопа Дж. (2007). «Катехоламины - активные соединения растений». Растениеводство. 172 (3): 433–40. Дои:10.1016 / j.plantsci.2006.10.013.
- ^ а б Ингл П.К. (2003). «Подшипниковые заводы L-DOPA» (PDF). Сияние натурального продукта. 2: 126–133. Получено 24 сентября 2015.
- ^ Wichers HJ, Visser JF, Huizing HJ, Pras N (1993). "Встречаемость L-ДОФА и дофамина в растениях и культурах клеток Mucuna Pruriens и влияние 2, 4-d и NaCl на эти соединения ». Растительные клетки, ткани и культура органов. 33 (3): 259–64. Дои:10.1007 / BF02319010. S2CID 44814336.
- ^ Лонго Р., Кастеллани А., Сберзе П., Тиболла М. (1974). «Распространение l-допа и родственных аминокислот в Vicia». Фитохимия. 13 (1): 167–71. Дои:10.1016 / S0031-9422 (00) 91287-1.
- ^ Ван Алстайн К.Л., Нельсон А.В., Вивьян Дж.Р., Кансилла Д.А. (июнь 2006 г.). «Дофамин действует как защита от травоядных у зеленой водоросли Ulvaria obscura умеренного климата». Oecologia. 148 (2): 304–11. Bibcode:2006 Oecol.148..304V. Дои:10.1007 / s00442-006-0378-3. PMID 16489461. S2CID 5029574.
- ^ а б c Саймон Дж. Д., Пелеш Д., Вакамацу К., Ито С. (октябрь 2009 г.). «Текущие проблемы в понимании меланогенеза: соединяющая химия, биологический контроль, морфология и функции». Исследования пигментных клеток и меланомы. 22 (5): 563–79. Дои:10.1111 / j.1755-148X.2009.00610.x. PMID 19627559.
- ^ Fedorow H, Tribl F, Halliday G, Gerlach M, Riederer P, Double KL (февраль 2005 г.). «Нейромеланин в нейронах дофамина человека: сравнение с периферическими меланинами и отношение к болезни Паркинсона». Прогресс в нейробиологии. 75 (2): 109–24. Дои:10.1016 / j.pneurobio.2005.02.001. PMID 15784302. S2CID 503902.
- ^ Эндрюс Р.С., Придхэм Дж. Б. (1967). «Меланины из ДОФА-содержащих растений». Фитохимия. 6 (1): 13–18. Дои:10.1016/0031-9422(67)85002-7.
- ^ Бельдад П., Брейкфилд П.М. (июнь 2002 г.). «Генетика и эволюция узоров крыльев бабочек». Обзоры природы. Генетика. 3 (6): 442–52. Дои:10.1038 / nrg818. PMID 12042771. S2CID 17417235.
- ^ Fahn S (2008). «История допамина и леводопы в лечении болезни Паркинсона». Двигательные расстройства. 23 Дополнение 3: S497–508. Дои:10.1002 / mds.22028. PMID 18781671. S2CID 45572523.
- ^ Бенеш FM (январь 2001 г.). «Карлссон и открытие дофамина». Тенденции в фармакологических науках. 22 (1): 46–47. Дои:10.1016 / S0165-6147 (00) 01607-2. PMID 11165672.
- ^ Баронды Ш. (2003). Лучше, чем прозак. Нью-Йорк: Издательство Оксфордского университета. стр.21–22, 39–40. ISBN 978-0-19-515130-5.
- ^ Ли Х, Деллаторе С.М., Миллер В.М., Мессерсмит ПБ (октябрь 2007 г.). «Химия поверхности в стиле мидий для многофункциональных покрытий». Наука. 318 (5849): 426–30. Bibcode:2007Научный ... 318..426L. Дои:10.1126 / science.1147241. ЧВК 2601629. PMID 17947576.
- ^ а б Драйер Д. Р., Миллер Д. Д., Фриман Б. Д., Пол Д. Р., Белявский С. В. (2013). «Перспективы поли (дофамина)». Химические науки. 4 (10): 3796. Дои:10.1039 / C3SC51501J.
- ^ а б c d е Lynge ME, van der Westen R, Postma A, Städler B (декабрь 2011 г.). «Полидофамин - природное полимерное покрытие для биомедицинской науки» (PDF). Наномасштаб. 3 (12): 4916–28. Bibcode:2011Nanos ... 3.4916L. Дои:10.1039 / c1nr10969c. PMID 22024699. Архивировано из оригинал 7 марта 2014 г.